奥希替尼
 | |
| 臨床資料 | |
|---|---|
| 商品名 | Tagrisso, Tagrix |
| 其他名稱 | AZD9291 |
| AHFS/Drugs.com | tagrisso |
| 核准狀況 | |
| 给药途径 | Oral 片剂 |
| ATC碼 | |
| 法律規範狀態 | |
| 法律規範 | |
| 藥物動力學數據 | |
| 血漿蛋白結合率 | Probably high[1] |
| 药物代谢 | Oxidation (CYP3A) |
| 生物半衰期 | 48 hours |
| 排泄途徑 | Feces (68%), urine (14%) |
| 识别信息 | |
| |
| CAS号 | 1421373-65-0 |
| PubChem CID | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| KEGG | |
| ChEBI | |
| PDB配體ID | |
| CompTox Dashboard (EPA) | |
| 化学信息 | |
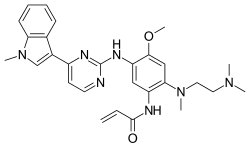
| 化学式 | C28H33N7O2 |
| 摩尔质量 | 499.62 g·mol−1 |
| 3D模型(JSmol) | |
| |
| |
奥希替尼 (英語:Osimertinib,又名奥沙替尼)[2][3] 是一种用于治疗非小细胞肺癌的小分子靶向抗肿瘤药物,[4][5] 它由阿斯利康公司开发,为第三代表皮生长因子受体抑制剂。该药物于2017年被FDA和欧盟批准用于治疗非小细胞肺癌,2018年被CFDA批准用于治疗晚期或转移性非小细胞肺癌。
临床用途
[编辑]奥希替尼用于治疗EGFR T790M基因突变阳性且第一代和第二代表皮生长因子受体抑制剂治疗无效的晚期或转移性非小细胞肺癌。[6]该突变往往是由于癌细胞天然耐药性或第一代及第二代表皮生长因子受体抑制剂(如吉非替尼、阿法替尼等)治疗过程中产生耐药性所导致的。[7]
在美国,用奥希替尼来治疗T790M阳性非小细胞肺癌的患者在治疗之前必须接受由联邦政府批准的伴随诊断测试来测定患者T790M突变的情况,从而确定合理的治疗方案,FDA已批准FoundationOne伴随诊断用于该测试。[8] 在欧洲和其他国家,T790M突变的情况可以通过基因诊断技术来分析。[9]
接受奥希替尼治疗的患者通常在开始治疗后大约第10个月产生耐药性。[10] 大多数临床的耐药性病例主要是由外显子20C797S突变所引起的。[11]
奥希替尼对胎儿有不利影响,故孕妇禁用此药。有间质性肺病或QT间期延长综合症的患者应慎用此药。[6]
用法用量
[编辑]既往至少接受过一种治疗的成人慢性淋巴细胞白血病(CLL)/小淋巴细胞淋巴瘤(SLL)患者:推荐剂量为每次 150 mg,口服,每日一次, 直至疾病进展或出现不可耐受的毒性。[12]
不良反应
[编辑]奥希替尼常见(大于10%)的不良反应包括腹泻、口腔炎、皮疹、皮肤干痒、甲沟炎、血小板下降和白细胞及低嗜中性白细胞降低等。[6]
奥希替尼偶见(1%-10%)的不良反应包括间质性肺病。[6]
药物相互作用
[编辑]奥希替尼在肝脏通过CYP3A4和CYP3A5代谢失活,大环内酯类抗生素、抗真菌药和抗病毒药物等肝药酶抑制剂能延长奥希替尼的作用时间,而利福平等肝药酶诱导剂会降低奥希替尼的疗效。[6]
药理学
[编辑]奥希替尼能与T790M突变阳性的EGFR蛋白结合;[6] 它还能与L858R突变阳性的EGFR结合并能使EFGR上的19外显子失活。
奥希替尼在体内的吸收及代谢过程遵循线性药物动力学,其血药浓度达峰时间约为6小时,半衰期约为48小时,清除率为14.2L/h。原形药经肝脏代谢后68%通过粪便排泄,14%通过尿液排泄。
化学结构
[编辑]临床上主要应用的为奥希替尼的甲磺酸盐(即甲磺酸奥希替尼),化学式为C28H33N7O2•CH4O3S,分子量为596g/mol,IUPAC名称为N-(2-2-二甲氨基乙基-甲基氨基-4-甲氧基-5-[4-(1-甲基吲哚-3-基)嘧啶-2-基]氨基苯基)丙-2-烯胺甲磺酸盐。
历史
[编辑]奥希替尼的研发于2009年开始,并于2012年取得目标化合物。该项目通过针对靶点的药物结构设计方法,旨在找到能选择性针对T790M突变阳性非小细胞癌的第三代表皮生长因子受体抑制剂。[13]
奥希替尼在第一阶段研究结果发表后于2014年4月被FDA指定加入突破治疗法案计划,[13] 并于2015年11月得到了FDA加速批准程序与优先审查。[14]
2016年2月EMA临时批准奥希替尼进入加速审批程序,它也是该程序成立以来第一个接受此程序的药物。[13]
药品经济学
[编辑]该药在美国上市初的价格为一个月疗程12,750美元。[15]:59
参考文献
[编辑]- ^ US Label (PDF). FDA. November 2015 [2019-07-17]. (原始内容存档 (PDF)于2017-02-16). Index page for NDA 208065 (页面存档备份,存于互联网档案馆)
- ^ Osimertinib. AdisInsight. [2017-02-27]. (原始内容存档于2018-08-23) (英语).
- ^ Proposed INN: List 113 (PDF). International Nonproprietary Names for Pharmaceutical Substances (INN). 2015, 29 (2): 285 [2015-11-16]. (原始内容存档 (PDF)于2017-04-28).
- ^ Ayeni D, Politi K, Goldberg SB. Emerging Agents and New Mutations in EGFR-Mutant Lung Cancer. Clin. Cancer Res. 2015, 21 (17): 3818–20. PMC 4720502
 . PMID 26169963. doi:10.1158/1078-0432.CCR-15-1211.
. PMID 26169963. doi:10.1158/1078-0432.CCR-15-1211.
- ^ Tan CS, Gilligan D, Pacey S. Treatment approaches for EGFR-inhibitor-resistant patients with non-small-cell lung cancer. Lancet Oncol. 2015, 16 (9): e447–59. PMID 26370354. doi:10.1016/S1470-2045(15)00246-6.
- ^ 6.0 6.1 6.2 6.3 6.4 6.5 UK label. UK Electronic Medicines Compendium. 2017-01-26 [2017-02-27]. (原始内容存档于2017-02-27) (英语).
- ^ Xu M, Xie Y, Ni S, Liu H. The latest therapeutic strategies after resistance to first generation epidermal growth factor receptor tyrosine kinase inhibitors (EGFR TKIs) in patients with non-small cell lung cancer (NSCLC). Ann Transl Med. 2015, 3 (7): 96. PMC 4430733
 . PMID 26015938. doi:10.3978/j.issn.2305-5839.2015.03.60.
. PMID 26015938. doi:10.3978/j.issn.2305-5839.2015.03.60.
- ^ Health, Center for Devices and Radiological. In Vitro Diagnostics - List of Cleared or Approved Companion Diagnostic Devices (In Vitro and Imaging Tools). www.fda.gov. [2018-01-17]. (原始内容存档于2018-01-25) (英语).
- ^ European Tagrisso information (PDF). European Medicines Agency. [2018-01-17]. (原始内容存档 (PDF)于2018-01-17).
- ^ Patel, Harun; Pawara, Rahul; Ansari, Azim; Surana, Sanjay. Recent updates on third generation EGFR inhibitors and emergence of fourth generation EGFR inhibitors to combat C797S resistance. European Journal of Medicinal Chemistry. 2017, 142: 32–47 [2019-07-17]. PMID 28526474. doi:10.1016/j.ejmech.2017.05.027. (原始内容存档于2018-08-23).
- ^ Wang, Shuhang; Song, Yongping; Liu, Delong. EAI045: The fourth-generation EGFR inhibitor overcoming T790M and C797S resistance. Cancer Letters. 2017, 385: 51–54 [2019-07-17]. PMID 27840244. doi:10.1016/j.canlet.2016.11.008. (原始内容存档于2020-09-01).
- ^ 奥布替尼片(CXHS1900035)申请上市技术审评报告 (PDF). wuxuwang. 2021-06-01 [2021-06-01]. (原始内容存档 (PDF)于2021-08-23) (cn).
- ^ 13.0 13.1 13.2 Yver, A. Osimertinib (AZD9291)-a science-driven, collaborative approach to rapid drug design and development.. Annals of Oncology. June 2016, 27 (6): 1165–70 [2019-07-17]. PMID 26961148. doi:10.1093/annonc/mdw129. (原始内容存档于2017-02-27).
- ^ Approved Drugs - Osimertinib. FDA Center for Drug Evaluation and Research. 2015-11-13 [2019-07-17]. (原始内容存档于2017-02-27) (英语).
- ^ AHRQ Healthcare Horizon Scanning System – Potential High-Impact Interventions Report Priority Area 02: Cancer (PDF). AHRQ. December 2015 [2019-07-17]. (原始内容 (PDF)存档于2017-04-30).
