4-二甲氨基吡啶
| 4-二甲氨基吡啶 | |
|---|---|
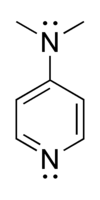
| |
| IUPAC名 4-Dimethylaminopyridine | |
| 別名 | 二甲氨基吡啶、N,N-二甲基吡啶胺 |
| 縮寫 | DMAP |
| 識別 | |
| CAS號 | 1122-58-3 |
| PubChem | 14284 |
| ChemSpider | 13646 |
| SMILES |
|
| InChI |
|
| InChIKey | VHYFNPMBLIVWCW-UHFFFAOYAL |
| 性質 | |
| 化學式 | C7H10N2 |
| 摩爾質量 | 122.17 g·mol⁻¹ |
| 熔點 | 110–113 ℃ |
| 沸點 | 162 ℃ (50 mmHg) |
| 溶解性(水) | 25℃:76 g/L 20℃:60 g/L |
| 危險性 | |
| 歐盟危險性符號 | |
| 警示術語 | R:R24/25, R36/38 |
| 安全術語 | S:S22, S36/37, S45 |
| MSDS | MSDS |
| 若非註明,所有數據均出自標準狀態(25 ℃,100 kPa)下。 | |
4-二甲氨基吡啶(DMAP)是一個吡啶衍生物,為無色至淡黃色晶體,是有機合成中應用很廣的萬能超親核的酰化反應催化劑。[1]
性質
[編輯]4-二甲氨基吡啶是無色至棕黃色晶體,從乙醚中析出的為淺黃色的片狀結晶。難溶於乙醚、異丙醚、己烷、環己烷,易溶於水、甲醇、苯、乙酸乙酯、氯仿、二氯甲烷、丙酮和乙酸。
製取
[編輯]DMAP的製取方法有很多種:雙吡啶鹽法是先用吡啶與氯氣反應生成4-吡啶基吡啶鹽正離子,然後再用二甲胺發生芳香親核取代反應生成4-二甲氨基吡啶:[2]
此外,將4-氯吡啶與33%二甲胺的水溶液在150℃加熱,將4-羥基吡啶、二甲胺鹽酸鹽和六甲基磷酰胺在220℃加熱4小時,以及從4-吡啶磺酸為原料,都可以製得DMAP。
用途
[編輯]4-二甲氨基吡啶是一個新型高效的酰化反應催化劑,可用於醇和酚的酰化成酯,胺的酰胺化,烯醇負離子的O-酰基化,異氰酸酯與羧酸反應生成酰胺,Baylis-Hillman反應、Steglich酯化反應、Staudinger合成、山口酯化反應、硅氫化反應,和醇的三苯甲基化成醚等多種反應。用於萜、甾體、糖及核苷等的合成,在有機合成、藥物、農藥、香料、染料、顏料合成和高分子領域有很多應用。
DMAP參與的反應有催化劑用量少,產率高,反應條件溫和,容易控制,反應時間短,以及適用的溶劑範圍廣等優點。DMAP對於空阻大、活性低醇類的酯化反應的催化作用尤其顯著,能使一般條件下難以完成的反應順利進行,產率一般較高。[3]
手性的DMAP類似物用於二級醇和Evans酰胺手性助劑等外消旋體的動力學拆分。[4][5][6] DMAP與溴化氰、高氯酸銀在乙腈中反應,可以得到穩定的1-氰基-4-二甲氨基吡啶高氯酸鹽,後者可以和含巰基的蛋白質/氨基酸如半胱氨酸,生成2-亞氨基-4-羧基噻唑啉啶。[7]
以對乙酸酐對醇的酰化的催化作用為例,說明DMAP的催化機理(下圖)。首先,DMAP的吡啶氮原子進攻乙酸酐親電的羰基碳,形成1-乙酰基-4-二甲氨基吡啶鹽,其中乙酰基二甲氨基吡啶鹽正離子與乙酸根離子形成一個不緊密的離子對。醇的氧原子親核進攻與吡啶相連的乙酰基碳原子,而後第一步產生的乙酸根離子立即奪取醇的氫,然後氧負把吡啶擠出去,產生酯,同時重新生成DMAP催化劑,進行下一個循環。DMAP的催化效果比類似的吡啶要強很多的原因,主要有以下幾點:
- DMAP中的二甲氨基有給電子效應,強烈地增加了吡啶環上的電子密度,使吡啶環氮原子的鹼性和親核性增強。
- 第一步形成的1-乙酰基-4-二甲氨基吡啶鹽分子中心電荷分散,形成一個連接不緊密的離子對,酸鹼催化下有利於親核試劑向活化的酰基進行進攻。
- 1-乙酰基-4-二甲氨基吡啶鹽正離子由於取代基的緣故,可以因共振效應而得到穩定。
對於pKa較小的底物如酚類,可能還有另一種機理,也就是DMAP先將酚羥基去質子化,然後是生成的酚負離子去進攻乙酸酐,氧負再把乙酸根離子擠出去,生成酯,同時生成的乙酸根把DMAP-H去質子化,DMAP去進攻另一個酚,再生酚負離子。[8]

危險性
[編輯]有毒!DMAP口服或與皮膚接觸有毒,很容易通過皮膚吸收,對眼部、皮膚和呼吸系統有刺激作用,大量使用時應穿有防護服、戴手套和防護面罩。大鼠經口LD50:140 mg/kg,兔皮下LD50:90 mg/kg。
參考資料
[編輯]- ^ 李報慶.高效酰化催化劑4-二甲氨基吡啶的合成研究[J].化學世界,1992,8:344-347.
- ^ Shinkichi Shimizu, Nanao Watanabe, Toshiaki Kataoka, Takayuki Shoji, Nobuyuki Abe, Sinji Morishita, Hisao Ichimura "Pyridine and Pyridine Derivatives" in "Ullmann's Encyclopedia of Industrial Chemistry" 2007; John Wiley & Sons: New York. doi:10.1002/14356007.a22_399
- ^ 李元東. 催化剂DMAP合成技术的改进. 科研實踐訓練項目論文. 2007-11-16 [2009-07-05].[永久失效連結]
- ^ Donald J Berry, Charles V Digiovanna, Stephanie S Metrick and Ramiah Murugan. Catalysis by 4-dialkylaminopyridines. Arkivoc. 2001: 201–226 [2009-07-05]. (原始內容存檔於2007-09-27).
- ^ Höfle, G., Steglich, W., Vorbrüggen, H. 4-Dialkylaminopyridines as Highly Active Acylation Catalysts. Angew. Chem. Int. Ed. Engl. 1978, 17: 569–583. doi:10.1002/anie.197805691.
- ^ Ryan P. Wurz. Chiral Dialkylamine Catalysts in Asymmetric Synthesis. Chem. Rev. 2007, 107: 5570–5595 [2009-07-05]. (原始內容存檔於2018-09-20).
- ^ Wakselman, M.; Guibé-Jampel, E.; Raoult, A.; Busse, W.D. Chem. Commun. 1976, 21.
- ^ S. Xu, I. Held, B. Kempf, H. Mayr, Wolfgang Steglich, H. Zipse. The DMAP-Catalyzed Acetylation of Alcohols - A Mechanistic Study (DMAP = 4-(dimethylamino)-pyridine). Chem. Eur. J. 2005, 11: 4751–4757. doi:10.1002/chem.200500398.
延伸閱讀
[編輯]- B. Neises, W. Steiglich (1990). "Esterification of Carboxylic Acids with Dicyclohexylcarbodiimide/4-Dimethylaminopyridine: tert-Butyl Ethyl Fumarate". Org. Synth.; Coll. Vol. 7: 93.
- I. Held, P. von den Hoff, D. S. Stephenson, H. Zipse. Domino Catalysis in the Direct Conversion of Carboxylic Acids to Esters. Adv. Synth. Cat. 2008, 11/12: 1891–1900. doi:10.1002/adsc.200800268.
外部連結
[編輯]- 4-二甲氨基吡啶中文來源說明(頁面存檔備份,存於網際網路檔案館),4-二甲氨基吡啶中文來源說明
- 藥物合成化學(8)-酰化反應(頁面存檔備份,存於網際網路檔案館),於李老師的專業blog
- DMAP的化學性質(頁面存檔備份,存於網際網路檔案館)(各類反應的例子見頁面下方的鏈接)(英文)
- DMAP在有機合成中的應用(英文)



