蛋白質結構預測

蛋白質結構預測(英語:Protein structure prediction)是指從蛋白質的氨基酸序列中預測蛋白質的三維結構。也就是說,從蛋白質一級結構預測它的摺疊和二級、三級、四級結構。結構預測與蛋白質設計的反問題有着根本的不同。蛋白質結構預測是生物信息學與理論化學所追求的最重要目標之一;它在醫學上(例如,在藥物設計)和在生物技術上(例如,新的酶的設計)都是非常重要的。每隔兩年,當前蛋白質結構預測技術的性能在蛋白質結構預測技術的關鍵測試(CASP)實驗中被評測。蛋白質結構預測的網絡服務器連續的評測是由社區項目CAMEO3D執行。
蛋白質結構和術語
[編輯]蛋白質是由氨基酸鏈通過肽鍵連接在一起。與α碳原子相連的C-N鍵和C-C鍵相對旋轉,產生了蛋白質主鏈的多種構象,也正是這些構象變化造成了蛋白質三維結構上的差異。每一個氨基酸的主鏈都是極性的,即 碳氧雙鍵上的碳原子帶正電性、氧原子帶負電性(δ+ C=O δ-),氧原子可以作為氫鍵受體;氮氫單鍵有(δ- N-H δ+),氮原子可以作為氫鍵供體。這些基團在蛋白質結構中便可以相互作用。根據側鏈結構的不同可以分為20種常見氨基酸,各自在蛋白質中扮演着重要的角色。甘氨酸(Glycine)的角色往往很特殊,因為它的側鏈是最小的,只有一個氫原子,沒有側鏈的空間位阻就增加了主鏈的局部靈活性。半胱氨酸(Cysteine)可以與另一個半胱氨酸發生交聯反應形成二硫鍵,使蛋白質整體更加穩定。
蛋白質結構的形成以二級結構元素(Secondary Structure Elements, SSE)為基礎,二級結構中有α螺旋和β摺疊,它們共同構成了蛋白質鏈的三級結構。在這些常見的二級結構中,相鄰的氨基酸之間形成氫鍵,主鏈也有類似的Φ(或者φ,Phi)和Ψ(Psi)角。
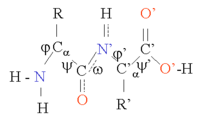
這些結構的形成使每個氨基酸主鏈的極性得到了中和和穩定。在疏水環境裡,二級結構常常緊密地堆疊形成蛋白質核心。每個氨基酸側鏈的體積的限制,加之與鄰近側鏈可能產生的相互作用的限制,我們需要運用分子模擬與結構疊合的手段來預測蛋白質的細微結構[1]。
α螺旋
[編輯]
α螺旋是在蛋白質二級結構中最豐富的類型。α螺旋的平均每個螺旋周期包含3.6個氨基酸,形成一個氫鍵,在每4個殘基中;平均長度為10個氨基酸(3個螺旋)或10埃(Å),但變化範圍5到40(Å)(1.5個至11個螺旋)。沿螺旋排列的氫鍵也構成了帶部分電荷的偶極矩,氮端帶部分正電。因為氮端有自由的氨基,可以與帶負電的基團,比如磷酸基團,進行反應。α螺旋常位於蛋白質核心區靠近表面的位置,有利于于水環境發生作用。面向蛋白內部的螺旋傾向於採用更多的疏水氨基酸,面向外部的多為親水氨基酸。因此,螺旋鏈上每四個氨基酸中位置處於的第三位的多為疏水,這也很特徵很容易被識別出。比如對亮氨酸拉鏈模體(Leucine zipper motif)有高度預測性的重複特徵是兩個相鄰的螺旋相對的面上均有亮氨酸的存在。螺旋輪圖可以顯示出這種重複性的特徵。其它的藏在蛋白質核心區或者細胞膜內的α螺旋會更經常分布疏水氨基酸,這樣的結構也更能被預測。 暴露在螺旋表面的氨基酸中疏水氨基酸所占的比例會更小。所以說氨基酸的類別組成可以用來預測α螺旋區域。那些有更多丙氨酸(Alanine,A)、穀氨酸(Glutamic acid,E)、亮氨酸(Leucine,L)、蛋氨酸(methionine,M),更少脯氨酸(Proline,P)、甘氨酸(Glycine,G)、酪氨酸(Tyrosine,Y)、絲氨酸 (Serine,S)的氨基酸容易形成α螺旋。脯氨酸通常破壞或者使α螺旋更不穩定,但是在更長可以存在因為它在α螺旋中形成一個彎折。
β摺疊
[編輯]環肽鏈
[編輯]此章節尚無任何內容,需要擴充。 |
捲曲
[編輯]一個二級結構的區域不是一個α螺旋,一個β摺疊,或可識別的轉動,通常被稱為一個捲曲(Coils)[1]。
蛋白質分類
[編輯]蛋白質結構和序列分類術語
[編輯]此章節尚無任何內容,需要擴充。 |
參考文獻
[編輯]- ^ 1.0 1.1 Mount DM. Bioinformatics: Sequence and Genome Analysis 2. Cold Spring Harbor Laboratory Press. 2004. ISBN 0-87969-712-1.
延伸閲讀
[編輯]- Majorek K, Kozlowski L, Jakalski M, Bujnicki JM. Chapter 2: First Steps of Protein Structure Prediction (PDF). Bujnicki J (編). Prediction of Protein Structures, Functions, and Interactions. John Wiley & Sons, Ltd. December 18, 2008: 39–62. ISBN 9780470517673. doi:10.1002/9780470741894.ch2.[失效連結]
- Baker D, Sali A. Protein structure prediction and structural genomics. Science. October 2001, 294 (5540): 93–6. Bibcode:2001Sci...294...93B. PMID 11588250. doi:10.1126/science.1065659.
- Kelley LA, Sternberg MJ. Protein structure prediction on the Web: a case study using the Phyre server (PDF). Nature Protocols. 2009, 4 (3): 363–71 [2020-03-05]. PMID 19247286. doi:10.1038/nprot.2009.2. hdl:10044/1/18157. (原始內容存檔 (PDF)於2017-09-22).
- Kryshtafovych A, Fidelis K. Protein structure prediction and model quality assessment. Drug Discovery Today. April 2009, 14 (7–8): 386–93. PMC 2808711
 . PMID 19100336. doi:10.1016/j.drudis.2008.11.010.
. PMID 19100336. doi:10.1016/j.drudis.2008.11.010. - Qu X, Swanson R, Day R, Tsai J. A guide to template based structure prediction. Current Protein & Peptide Science. June 2009, 10 (3): 270–85. PMID 19519455. doi:10.2174/138920309788452182.
- Daga PR, Patel RY, Doerksen RJ. Template-based protein modeling: recent methodological advances. Current Topics in Medicinal Chemistry. 2010, 10 (1): 84–94. PMC 5943704
 . PMID 19929829. doi:10.2174/156802610790232314.
. PMID 19929829. doi:10.2174/156802610790232314. - Fiser, A. Template-based protein structure modeling. Methods in Molecular Biology 673. 2010: 73–94. ISBN 978-1-60761-841-6. PMC 4108304
 . PMID 20835794. doi:10.1007/978-1-60761-842-3_6.
. PMID 20835794. doi:10.1007/978-1-60761-842-3_6. |journal=被忽略 (幫助) - Cozzetto D, Tramontano A. Advances and pitfalls in protein structure prediction. Current Protein & Peptide Science. December 2008, 9 (6): 567–77. PMID 19075747. doi:10.2174/138920308786733958.
- Nayeem A, Sitkoff D, Krystek S. A comparative study of available software for high-accuracy homology modeling: from sequence alignments to structural models. Protein Science. April 2006, 15 (4): 808–24. PMC 2242473
 . PMID 16600967. doi:10.1110/ps.051892906.
. PMID 16600967. doi:10.1110/ps.051892906.
參閱
[編輯]外部連結
[編輯]- (英文)CASP experiments home page (頁面存檔備份,存於網際網路檔案館)
- (英文)ExPASy 蛋白質組學工具 (頁面存檔備份,存於網際網路檔案館) — 預測工具和服務器的列表
