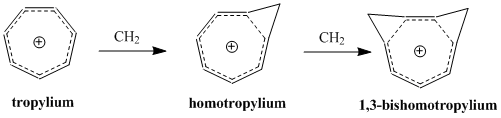
同芳香性

同芳香性(英語:homoaromaticity)在有機化學中是一種特殊的芳香性,一般指共平面的輪烯被sp3雜化的碳原子所隔斷時產生的特殊芳香性。傳統芳香性的定義認為這一類破壞了p軌道重疊的連續性且非共面的分子不具有芳香性,但卻仍觀察到此類物質具有相當大的熱力學穩定性及與芳香族化合物相似的光譜、磁性和化學特性[1]。
同芳香性的概念最早由Saul Winstein於1959年提出,他在研究非經典碳正離子的報道里提及了這一名詞[2]。迄今為止,已知的同芳香性化合物多以陽離子或陰離子的形式存在,關於中性同芳香性分子的研究較為罕見[3]。 環辛四烯在濃硫酸中被質子化產生的C8H9+離子[註 1],是研究最多的同芳香性陽離子。
歷史
[編輯]命名
[編輯]同芳香性一詞中的「同」源於其是衍生自共軛烯烴同系物的芳香性[2],含義是與對應的共軛烯烴結構有着相似的芳香性,IUPAC金皮書要求使用bis-、tris-等前綴來命名被二、三及更多個sp3碳所中斷的對應共軛芳香物質,並在前冠homo-。
闡明
[編輯]同芳香性的發現源於1950年代對非經典碳正離子的爭論,非經典碳正離子模型的支持者Saul Winstein在研究3-二環[3.1.0]己基陽離子時首次提出了同芳香性的概念。

在一系列的乙酰化實驗中,Winstein等人觀察到對甲苯磺酰基離去基團在位於分子赤道面時,經驗上發現其溶劑解反應會發生的極快。該小組將反應速率的差異歸因於順式異構體引發的鄰助效應,並借這一結論支持了非經典碳正離子結構的觀點[4]。
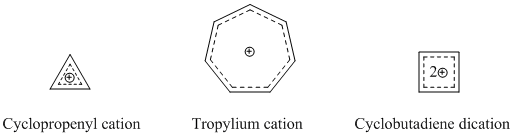
Winstein隨後觀察到,此類3-二環[3.1.0]己基陽離子模型與具芳香性的環丙烯陽離子類似——正電荷分散在三個含兩個π電子的等效碳上。這種模型的電子數目滿足休克爾規則,Winstein注意到環丙烯陽離子與非經典碳正離子的唯一區別在於,後者的共軛性被-CH2-單元所阻斷。因此該小組提出了「三同環丙烯基[註 2]」這一物質,這是一種環丙烯陽離子所對應的具有同芳香性的同系物。
同芳香性的證明
[編輯]標準
[編輯]芳香性的判斷標準隨着科學進步和觀點交換已經日臻完善,不過,對於芳香性分子所應具的標準條件仍是有爭議的[5]。傳統觀點認為,具有符合休克爾規則的平面共軛系統是芳香族化合物的判斷標準。此外,這些共軛的環狀系統還需要擁有相較於普通共軛體系所不具有的高熱化學穩定性和磁特徵。簡而言之,芳香族化合物的三個主要特徵為[6]:
- 滿足休克爾規則
- 高熱化學穩定性
- 光譜和磁性特性
需要注意的是,芳香性的概念是用於對某一類化合物(即芳香化合物)的特殊穩定性的描述,而非表達某一理論的術語[7][註 3]。並且,芳香性的傳統定義也存在許多例外情況,例如符合 Möbius體系的Craig模型[8]、周環過渡態分子、電子通過σ離域的分子、一些過渡金屬夾心型配合物等都擁有類似芳香性的特徵而不滿足標準的先決條件[9]。
因此,同芳香性離域的標準也有些含糊和有待探討。同䓬離子C
8H+
9雖然不是第一個被發現的同芳香性化合物,但卻是相關研究最多的同芳香性化合物,也被認為是最經典的同芳香性代表物。至1980年代中期,已有40餘種C
8H+
9衍生物的研究報道,可以說現在對於同芳香性的認知很多是基於C
8H+
9發展而來的[6]。
早期證明
[編輯]在Winstein發表同芳香性結構的初期研究後,引發了許多小組對類似結構物質的報告。其中最多的便是環辛四烯被強酸質子化後得到的陽離子,其母體最先由Pettit等人作為穩定的鹽分離得到[10]。同芳香性的早期證明都是基於該物質的表徵。
NMR
[編輯]通過1H NMR光譜表徵環辛三烯陽離子時,Pettit小組觀察到,其中一個亞甲基上的兩個質子有着驚人化學位移值差距。

Pettit等人由此得出結論,環辛三烯基陽離子的經典結構一定是不正確的。相反,他們提出了二環[5.1.0]辛二烯基的結構,並認為環丙烷上的電子存在相當大的離域,以解釋化學位移值的巨大差異。進一步考慮後,Pettit傾向於將該結構以同芳香性陽離子的結構表示,這種結構通過電子離域而非簡單的「環丙烷結構」來解釋其光譜差異性,並且六個π電子也是符合休克爾規則的。NMR的磁場可以在該離子中感應到環電流,解釋了面內外質子特性的反常差異。Pettit等人也強調了該物質與具芳香性的䓬離子的相似性,將其描述為䓬離子的「同系對應物[註 4]」,這與Winstein所預測的同芳香性一致[10]。
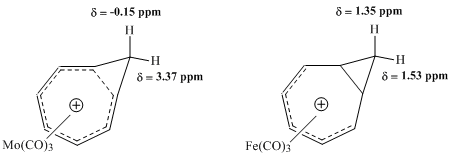
1965年,Winstein等人發表了對同䓬離子金屬羰基配合物的NMR研究報告,其中鉬與鐵配合物的比較非常直觀——三羰基鉬預期通過接受六個π電子與環庚三烯陽離子配位,保留了配合物的同芳香性特徵;相對的,三羰基鐵僅接受了四個π電子配位,從而產生了定域電子的配合物。1H NMR光譜表徵顯示,鉬配合物的對應亞甲基質子位移值存在很大的差異,而鐵配合物中的位移值卻相差甚微[11]。
UV
[編輯]紫外光譜也是早期證明同芳香性存在的重要證據之一。Winstein等人確定,與擁有環丙烷結構(和定域結構)的二環[5.1.0]辛二烯基或是經典結構的環辛三烯基陽離子相較有紅移,其UV光譜類似於環庚三烯陽離子。進一步的計算使Winstein確定了與面外亞甲基相鄰的兩個碳原子之間的鍵級和䓬中的π鍵的鍵級相當[12]。儘管該實驗有足夠的啟發性,但有觀點認為UV光譜的計算數據不能作為關鍵的證據[6]。
近期證明
[編輯]近來有通過X射線衍射分析同䓬離子結構的研究,研究結果表明,該環丙烷結構的底部碳原子的核間距確實比普通的環丙烷分子更長,而面外的鍵長似乎更短,證明「環丙烷鍵」參與了環內的離域[6]。
分子軌道理論解釋
[編輯]微擾分子軌道
[編輯]同芳香性分子的穩定性可以用分子軌道理論來解釋,大部分的描述集中於環䓬離子。Robert C. Haddon嘗試用莫比烏斯模型來解釋,其中sp3雜化的亞甲基橋碳原子的外層電子反饋給相鄰的碳原子,以穩定二者的間距[13]。 Haddon在1975年的研究中稱,使用微擾分子軌道理論(PMO)[註 5]可以更好地解釋同芳香性。由於添加了一根同共軛鍵[註 6]干擾了原始陽離子的共振,同䓬離子可以被認為是䓬離子的微擾版本[14]。

一階效應
[編輯]影響同芳香性的最重要因素是在母體上添加一個同共軛鍵,由於所有的同芳香性化合物都衍生自具有對稱性和鍵級平均化的芳香化合物,因此同共軛鍵的插入的位置並不重要。同共軛鍵的插入對π電子的密度微擾量為δβij,其值取決於環的大小,並且總在0到1之間,其中0代表無微擾,1代表完全喪失芳香性(即開鏈)[14]。據信,隨着環的增大,同芳香性的共振穩定性被形成同共軛鍵的張力所抵消。同芳香烴的最大環尺寸相當小,一個16元的輪烯環會更傾向於形成芳香性的雙陽離子[15]。
二階效應
[編輯]同共軛鍵合
[編輯]向同芳香性的分子添加第二個同共軛鍵會對其微擾分子軌道模型和穩定性產生顯著的二階效應影響。儘管PMO中有一項取決於兩個同共軛鍵的接近程度,但二階效應通常會帶來成倍的不穩定性(相較於添加單個同共軛鍵)。為了使δβij最小化,從而保持耦合項最小化,雙同芳香性物質的形成取決於共振穩定性最大、空間位阻最小的構象。為了使順-二環[6.1.0]壬-2,4,6-三烯質子化合成1,3-雙同環庚三烯陽離子的過程符合理論計算,便在1、3位碳上形成兩個亞甲基橋來最大化穩定性[14]。

取代基
[編輯]向同芳香性化合物上添加取代基會對其穩定性造成較大影響,根據取代基與同共軛鍵的相對位置,取代基可以具有穩定或去穩定作用。以同䓬離子為例,如果在1、3位碳上的取代基為給電子基團,則對同芳香性環有穩定作用。然而,若是在2、4位碳上,則取代基與同共軛鍵間的相互作用會使同芳香性環變得不穩定。因此甲基或苯基取代的環辛四烯質子化會得到1-取代的產物[14]。

同芳香性化合物
[編輯]下示化合物的同芳香性皆已經通過理論預測和實驗證明。
陽離子同芳香性化合物
[編輯]最廣為人知的同芳香性物質是陽離子型同芳香性化合物,如前文所述,最經典的同環庚三烯陽離子便是研究最多的同芳香性化合物之一。許多複雜的同芳香性分子都是以環丙烯陽離子、環庚三烯陽離子和環丁二烯陽離子為基礎衍生的,而這些物質都是有着顯著芳香性的陽離子[16]。
除同䓬離子以外,另一種研究較多的陽離子型同芳香性化合物是降冰片-7-烯基陽離子,其已被實驗證明有着特殊的穩定性[17]。

寶塔烷的雙陽離子是一個十分有趣的σ-雙同芳香性實例,出現了4c-2e,電子在中心平面四邊形上離域(其原型的σ-芳香性現象是基於環丙烷的,從該效應中獲得了約11.3 kcal/mol的穩定化能)。可以通過氧化寶塔烷或氧化對應的雙-斷-十二面烷二烯[註 7][18]:
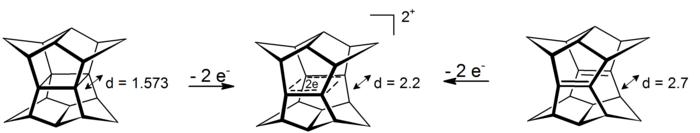
中性同芳香性化合物
[編輯]中性的同芳香性化合物雖能分出許多種,但關於它們的特殊穩定性,究竟是來源於同芳香性,還是其他結構上的原因,仍是有待討論的。被單個亞甲基橋隔斷的中性同芳香性化合物被稱作單同芳香烴[註 8],如環庚三烯。也有人認為C60的單亞甲基橋衍生物是具同芳香性的物質,UV和NMR分析表明,這種改性富勒烯的芳香特性不會被同共軛鍵的加入而破壞[19]。
雙同芳香化合物
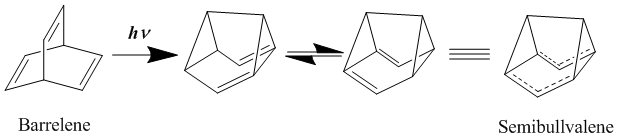
[編輯]中性同芳香性的代表是雙同芳香性化合物(bishomoaromatics),如桶烯和半瞬烯。半瞬烯在1966年被合成[20],結構上符合同芳香性理論,不過關於其衍生物是否能以離域、基態的中性同芳香性化合物形式存在仍有許多爭論。有研究使用合適取代基衍生化半瞬烯穩定離域過渡態結構,該重排的活化能可以進一步降低,但不能被消除[21][22]。此外,向分子中引入環張力,成環來破壞定域基態穩定結構,是可以得到離域同芳香性基態結構的[23]。
雜原子同芳香性化合物
[編輯]同芳香性不局限於烴類,部分硼、硅[24]化合物也被認為是具同芳香性的中性化合物,如1,2-二硼雜環丁烷和1,2-二硼雜環戊烷。與定域結構式相比,離域結構的1,2-二硼雜環丁烷具有更高的穩定性,表現出顯著的同芳香性[25]。當硼原子上的基團為給電子基時,有利於經典的定域分子模型;反之硼與吸電子基相連時,則會表現出明顯的同芳香性特徵。

三同芳香化合物
[編輯]顧名思義,三同芳香性化合物比雙同芳香性化合物多一個額外的面外亞甲基,因此含有三個同共軛鍵。與半瞬烯相似,三同芳香性化合物的同芳香性特徵仍存在諸多爭論。理論上它們具有同芳香性,不過複雜的分子內效應使它們的穩定性均不超過苯的5 % [26]。

陰離子同芳香性化合物
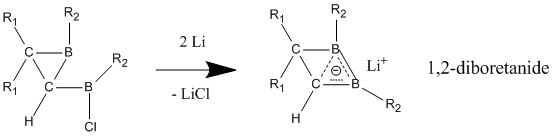
[編輯]與中性同芳香性分子不同,陰離子同芳香性化合物表現出的同芳香性被廣泛認可。陰離子型同芳香性化合物可以通過鋰還原其母體分子得到,1,2-二硼雜環丁烷陰離子的3c-2e鍵表現出強烈的同芳香性,與其中性母體相比C-B鍵更短[27]。此類衍生物可以通過不同的取代基擴展為更大的環,並保有一定程度的同芳香性。
雙二氮烯類化合物也表現出不同程度的同芳香性,其雙陰離子出現了4c-6e鍵,實驗結果顯示N-N間的距離縮短了,證明發生了離域。這一系統內的情況是極其特殊的,電子在四元環σ共軛體系內離域,是首個被證實的4c-6e σ-雙同芳香性化合物[28][29]。
同反芳香性
[編輯]近來也有同反芳香性的研究報道,類似於芳香性化合物展現出的穩定性,反芳香性化合物包含4nπ電子的閉環,穩定性較差。二環[3.2.1]辛-3,6-二烯-2-基陽離子中僅含4個π電子,被認為是「雙同反芳香烴[註 9]」,計算結果也表明其穩定性比相應的烯丙基陽離子要差[30]。
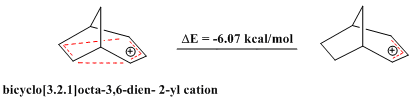
其4-氟苯基衍生物也被證明是反芳香性化合物[30]。

外部連結
[編輯]備註
[編輯]參見
[編輯]參考文獻
[編輯]- ^ 國際純化學和應用化學聯合會,化學術語概略,第二版。(金皮書)(1997)。在線校正版: (2006–) "Homoaromatic"。doi:10.1351/goldbook.H02839
- ^ 2.0 2.1 Winstein, S. Homo-Aromatic Structures. J. Am. Chem. Soc. 1959, 81 (24): 6523. doi:10.1021/ja01533a052.
- ^ Freeman, P. K. Neutral Homoaromaticity in Some Neutral Heterocycles. J. Org. Chem. 2005, 70 (6): 1998–2001. PMID 15760178. doi:10.1021/jo040250o.
- ^ Winstein, S.; Sonnenberg, J.; DeVries, L. The Tris-Homocyclopropenyl Cation. J. Am. Chem. Soc. 1959, 81 (24): 6523–6524. doi:10.1021/ja01533a051.
- ^ le Noble, W. J. "Aromaticity" in Highlights of Organic Chemistry: an advanced textbook; Marcel Dekker, Inc.: New York, 1974. ISBN 0-8247-6210-X
- ^ 6.0 6.1 6.2 6.3 Childs, R. F. The Homotropylium Ion and Homoaromaticity. Acc. Chem. Res. 1984, 17 (10): 347–352. doi:10.1021/ar00106a001.
- ^ Hua Yuhui; Zhang Hong; Xia Haiping. History and Development 38 (1): 11–28. 2018. doi:10.6023/cjoc201709009.
- ^ D. P. Craig, A Novel Type of Aromaticity, Nature, 1958, 181: 1052
- ^ Schleyer, P. R. Introduction: Aromaticity. Chem. Rev. 2001, 101 (5): 1115–1118. PMID 11749368. doi:10.1021/cr0103221
 .
.
- ^ 10.0 10.1 Rosenburg, J. L.; Mahler, J. E.; Pettit, R. J. The Bicyclo[5.1.0]octadienyl Cation, A New Stable Carbonium Ion. J. Am. Chem. Soc. 1962, 84 (14): 2842–2843. doi:10.1021/ja00873a051.
- ^ Winstein, S.; Kaesz, H.D.; Kreiter, C.G.; Friedrich, E.C. Homotropylium Ion and its Molybdenum Tricarbonyl Complex. J. Am. Chem. Soc. 1965, 87 (14): 3267–3269. doi:10.1021/ja01092a060.
- ^ Winstein, S.; Kreiter, C.G.; Brauman, J.I. Ring Inversion, Ultraviolet Spectrum, and Electronic Structure of the Monohomotropylium Ion. J. Am. Chem. Soc. 1966, 88 (9): 2047–2048. doi:10.1021/ja00961a037.
- ^ Haddon, R.C. The structure of the homotropenylium cation. Tetrahedron Lett. 1975, 16 (11): 863–866. doi:10.1016/S0040-4039(00)72004-1.
- ^ 14.0 14.1 14.2 14.3 Haddon, R.C. Perturbational molecular orbital (PMO) theory of homoaromaticity. J. Am. Chem. Soc. 1975, 97 (13): 3608–3615. doi:10.1021/ja00846a009.
- ^ Oth, J.F.M.; Smith, D.M.; Prange, U.; Schröder, G. A [16]Annulenediyl Dication. Angew. Chem. Int. Ed. Engl. 1973, 12 (4): 327–328. doi:10.1002/anie.197303271.
- ^ Sal'nikov, G.E.; Genaev, A.M.; Mamatyuk, V.I.; Shubin, V.G. Homophenalenyl cations, new representatives of homoaromatic systems. Russ. J. Org. Chem. 2008, 44 (7): 1000–1005. S2CID 93688550. doi:10.1134/S1070428008070099.
- ^ Carey, F.A.; Sundberg, R.J. Advanced Organic Chemistry: Part A: Structure and Mechanism; Kluwer Academic/Plenum Publishers: New York, 2000; 327-334. ISBN 978-0-387-68346-1
- ^ Prinzbach, H.; Gescheidt, G.; Martin, H.-D.; Herges, R.; Heinze, J.; Prakash, G. K. Surya; Olah, G. A. Cyclic electron delocalization in hydrocarbon cages (pagodanes, isopagodanes, (bisseco-/seco-)-(dodecahedradienes)). Pure and Applied Chemistry: 673–682, 1995. S2CID 96232491. doi:10.1351/pac199567050673.
- ^ Suzuki, T.; Li, Q.; Khemani, K.C.; Wudl, F. Dihydrofulleroid H3C61: synthesis and properties of the parent fulleroid. J. Am. Chem. Soc. 1992, 114 (18): 7301–7302. doi:10.1021/ja00044a055.
- ^ Zimmerman, H. E.; Grunewald, G. L. The Chemistry of Barrelene. III. A Unique Photoisomerization to Semibullvalene. Journal of the American Chemical Society. 1966, 88: 183–184. doi:10.1021/ja00953a045.
- ^ Dewar, M.J.S.; Lo, D.H. Ground states of .sigma.-bonded molecules. XIV. Application of energy partitioning to the MINDO/2 method and a study of the Cope rearrangement. J. Am. Chem. Soc. 1971, 93 (26): 7201–7207. doi:10.1021/ja00755a014.
- ^ Hoffman, D.; Stohrer, W-D. Cope rearrangement revisited. J. Am. Chem. Soc. 1971, 93 (25): 6941–6948. doi:10.1021/ja00754a042.
- ^ Griffiths, P. R.; Pivonka, D. E.; Williams, R. V. The Experimental Realization of a Neutral Homoaromatic Carbocycle. Chemistry: A European Journal. 2011, 17 (33): 9193–9199. PMID 21735493. doi:10.1002/chem.201100025.
- ^ Keuter J; Hepp A; Massolle A; Neugebauer J; Mück-Lichtenfeld C; Lips F. Synthesis and Reactivity of a Neutral Homocyclic Silylene. Angew Chem Int Ed Engl. 2022, 61 (5). PMID 34797603. doi:10.1002/anie.202114485.
- ^ Steiner, D.; Balzereit, C.; Winkler, H. J. R.; Stamatis, N.; Massa, W.; Berndt, A.; Hofmann, M.; Von Ragué Schleyer, P. Nonclassical 1,2-Diboretanes and 1,2-Diborolanes. Angewandte Chemie International Edition in English. 1994, 33 (22): 2303–2306. doi:10.1002/anie.199423031.
- ^ Martin, H.D.; Mayer, B. Proximity Effects in Organic Chemistry?The Photoelectron Spectroscopic Investigation of Non-Bonding and Transannular Interactions. Angew. Chem. Int. Ed. Engl. 1983, 22 (4): 283–314. doi:10.1002/anie.198302831.
- ^ Steiner, D.; Winkler, H.; Balzereit, C.; Happel, T.; Hofmann, M.; Subramanian, G.; Schleyer, P.V.R.; Massa, W.; Berndt, A. 1,2-Diboretanides: Homoaromatic 2π-Electron Compounds with High Inversion Barriers. Angew. Chem. Int. Ed. Engl. 1996, 35 (17): 1990–1992. doi:10.1002/anie.199619901.
- ^ Exner, K.; Hunkler, D.; Gescheidt, G.; Prinzbach, H. Do Nonclassical, Cyclically Delocalized 4N/5e Radical Anions and 4N/6e Dianions Exist? – One- and Two-Electron Reduction of Proximate, Synperiplanar Bis-Diazenes. Angew. Chem. Int. Ed. Engl. 1998, 37 (13–14): 1910–1913. doi:10.1002/(SICI)1521-3773(19980803)37:13/14<1910::AID-ANIE1910>3.0.CO;2-D.
- ^ Exner, K.; Cullmann, O.; Vögtle, M.; Prinzbach, H.; Grossmann, B.; Heinze, J.; Liesum, L.; Bachmann, R.; Schweiger, A.; Gescheidt, G. Cyclic In-Plane Electron Delocalization (σ-Bishomoaromaticity) in 4N/5e Radical Anions and 4N/6e Dianions – Generation, Structures, Properties, Ion-Pairing, and Calculations. J. Am. Chem. Soc. 2000, 122 (43): 10650–10660. doi:10.1021/ja0014943.
- ^ 30.0 30.1 Volz, H.; Shin, J. Bicyclo[3.2.1]octa-3,6-dien-2-yl Cation: A Bishomoantiaromate. J. Org. Chem. 2006, 71 (6): 2220–2226. PMID 16526766. doi:10.1021/jo0515125.



