锕
锕在1899年被发现,是首个得到分离的非原始元素。虽然钋、镭和氡比锕更早被发现,但是科学家到1902年才分离出这些元素。
锕具有高度的放射性,最稳定的锕同位素是227Ac,会进行β衰变,半衰期为21.772年。由于缺乏长寿命的同位素,在自然界中只有痕量的锕出现在铀矿石当中,以227Ac为主,为235U的衰变产物。每一吨铀矿石约含0.2毫克的锕元素。由于锕和镧的化学和物理特性过于接近,因此要从矿石中分离出锕元素并不现实。科学家则是在核反应炉中以中子照射镭-226来生产锕的。
锕因为稀少、昂贵,且具强放射性,所以没有大的工业用途。目前锕被用作中子源,以及在放射线疗法中作为辐射源。
历史
[编辑]法国化学家安德烈-路易·德比埃尔内在1899年宣布发现新元素。在玛莉·居礼和皮埃尔·居礼从沥青铀矿中分离出镭之后,德贝尔恩接著从残留物中再分离出这一新元素。他认为该元素与钛和钍相似,并将其命名为“actinium”。[3][4]德国化学家弗里德里希·奥斯卡·吉塞尔则在1902年独立发现了锕元素。[5]他认为锕与镧相似,并在1904年将其命名为“emanium”。[6]科学家在比较德贝尔恩所得出的半衰期数据后,[7]决定依最早发现者的意愿把该元素正式定名为“actinium”。[6][8]
锕的原文名称“actinium”源自古希腊语中的“ακτίς”、“ακτίνος”(“aktis”、“aktinos”),意为光线。[9]其化学符号为Ac,但Ac也同时是其他化学品的缩写,如乙酰基、乙酸盐[10]和乙醛,但锕与这些并无关系。[11]
属性
[编辑]锕是一种柔软的银白色[12][13]放射性金属。其剪切模量估计与铅相近。[14]锕的放射性很强,它放射出的高能粒子足以把四周的空气电离,因而发出暗蓝色光。[15]锕的化学属性与包括镧在内的镧系元素相近,因此要将锕从铀矿石中分离出来十分困难。分离过程一般使用溶剂萃取法和离子层析法。[16]
锕是首个锕系元素。这些元素彼此间的特性比镧系元素更多元化,因此直到1945年,格伦·西奥多·西博格才提出为元素周期表加入锕系元素。这是自从德米特里·门捷列夫创造元素周期表以来对周期表最大的变动之一。[17]
锕在空气中会与氧气、水气迅速反应,在表面产生白色的保护性氧化层。[12]与大部份镧系和锕系元素一样,锕的氧化态通常是+3;Ac3+离子在溶液中无色。[18]锕的电子排布是6d17s2,所以当失去3个电子后,就会形成稳定的闭壳层,与惰性气体氡一样。[13]锕的+2态只出现在二氢化锕(AcH2)中。[19]
化合物
[编辑]已知的锕化合物非常少,其中有三氟化锕(AcF3)、三氯化锕(AcCl3)、三溴化锕(AcBr3)、氟氧化锕(AcOF)、氯氧化锕(AcOCl)、溴氧化锕(AcOBr)、三硫化二锕(Ac2S3)、氧化锕(Ac2O3)和磷酸锕(AcPO4)等。这些化合物中锕都具有+3氧化态,且都有相对应的镧化合物。[18][20]对应的镧和锕化合物在晶格常数上的差异不超过百分之十。[20]
| 化学式 | 颜色 | 对称 | 空间群 | 空间群数 | 皮尔逊符号 | a(pm) | b(pm) | c(pm) | Z | 密度( g/cm3) |
|---|---|---|---|---|---|---|---|---|---|---|
| Ac | 银白色 | fcc[19] | Fm3m | 225 | cF4 | 531.1 | 531.1 | 531.1 | 4 | 10.07 |
| AcH2 | 立方晶系[19] | Fm3m | 225 | cF12 | 567 | 567 | 567 | 4 | 8.35 | |
| Ac2O3 | 白色[12] | 三方晶系[21] | P3m1 | 164 | hP5 | 408 | 408 | 630 | 1 | 9.18 |
| Ac2S3 | 立方晶系[22] | I43d | 220 | cI28 | 778.56 | 778.56 | 778.56 | 4 | 6.71 | |
| AcF3 | 白色[23]:71 | 六方晶系[20][21] | P3c1 | 165 | hP24 | 741 | 741 | 755 | 6 | 7.88 |
| AcCl3 | 六方晶系[20][24] | P63/m | 165 | hP8 | 764 | 764 | 456 | 2 | 4.8 | |
| AcBr3 | 白色[20] | 六方晶系[24] | P63/m | 165 | hP8 | 764 | 764 | 456 | 2 | 5.85 |
| AcOF | 白色[23]:87-88 | 立方晶系[20] | Fm3m | 593.1 | 8.28 | |||||
| AcOCl | 四方晶系[20] | 424 | 424 | 707 | 7.23 | |||||
| AcOBr | 四方晶系[20] | 427 | 427 | 740 | 7.89 | |||||
| AcPO4·0.5H2O | 六方晶系[20] | 721 | 721 | 664 | 5.48 |
上表中的a、b和c为晶格常数,Z为每晶胞所含的化学式单元数。密度并非实验数据,而是从晶体参数中计算得出的。
氧化物
[编辑]在真空中把氢氧化锕加热至500°C或把草酸锕加热至1100°C,可制成氧化锕(Ac2O3)。氧化锕的晶体结构与大部份三价稀土金属的氧化物同型。[20]
卤化物
[编辑]三氟化锕的合成反应可以在液态或固态下进行。前者在室温下进行,需将氢氟酸加入含有锕离子的溶液中。后者需对锕金属施以氟化氢气体,反应要在700°C下进行,并必须使用全铂制器材。在900至1000°C下,三氟化锕会和氢氧化铵反应形成氟氧化锕(AcOF)。虽然三氟化镧在空气中以800°C燃烧一小时后就可以产生氟氧化镧,但是类似的方法无法产生氟氧化锕,而是会把三氟化锕熔解。[20][23]:87–88
- AcF3 + 2 NH3 + H2O → AcOF + 2 NH4F
氢氧化锕或草酸锕与四氯化碳在960°C以上温度反应会产生三氯化锕。同样,三氯化锕与氢氧化铵在1000°C反应会形成氯氧化锕。但与氟氧化锕不同的是,三氯化锕在氢氯酸溶液中用氨点燃就可以产生氯氧化锕。[20]
溴化铝与氧化锕反应后,会形成三溴化锕:
- Ac2O3 + 2 AlBr3 → 2 AcBr3 + Al2O3
在500°C加入氢氧化铵,可以产生溴氧化锕(AcOBr)。[20]
其他化合物
[编辑]三氯化锕在300°C下经钾还原后,可形成氢化锕,其结构可从氢化镧(LaH2)的结构推测而得。该反应中氢的来源不明。[23]:43
在含锕的氢氯酸溶液中加入磷酸二氢钠(NaH2PO4),会产生白色的半水合磷酸锕(AcPO4·0.5H2O)。草酸锕和硫化氢气体在1400°C受热几分钟,会产生黑色的硫化锕(Ac2S3)。[20]
同位素
[编辑]锕一共有36种已知同位素,全部都具有放射性。这些同位素的原子量介乎206 u(206
Ac)和236 u(236
Ac)。[25]其中最稳定的有:227
Ac(半衰期为21.772年)、225
Ac(10.0天)和226
Ac(29.37小时)。其馀的同位素的半衰期都小于10小时,大部份甚至小于1分钟。寿命最短的锕同位素是217
Ac,其半衰期只有69纳秒,会进行α衰变和中子捕获。锕拥有两个亚稳态(同核异构体)。[25]研究锕的化学性质时会用225Ac、227Ac、228Ac这三种同位素。[2]
自然界中的锕元素主要由227
Ac组成,此外还有极微量的225
Ac和228
Ac。纯化后的227
Ac在185天后与衰变产物达成平衡。它主要进行β衰变(98.8%),以及少量的α衰变(1.2%)。[18]这些衰变的产物都属于锕衰变系。227
Ac发射的β粒子能量较低(46 keV),α辐射的强度较低,可用样本也一般很少,所以很难直接探测到227
Ac。因此科学家一般以探测其衰变产物的方法来推算227
Ac的量。[18]
| 同位素 | 合成反应 | 衰变形式 | 半衰期 |
|---|---|---|---|
| 221Ac | 232Th(d,9n)225Pa(α)→221Ac | α | 52毫秒 |
| 222Ac | 232Th(d,8n)226Pa(α)→222Ac | α | 5.0秒 |
| 223Ac | 232Th(d,7n)227Pa(α)→223Ac | α | 2.1分钟 |
| 224Ac | 232Th(d,6n)228Pa(α)→224Ac | α | 2.78小时 |
| 225Ac | 232Th(n,γ)233Th(β−)→233Pa(β−)→233U(α)→229Th(α)→225Ra(β−)225Ac | α | 10天 |
| 226Ac | 226Ra(d,2n)226Ac | α、β−、电子捕获 | 29.37小时 |
| 227Ac | 235U(α)→231Th(β−)→231Pa(α)→227Ac | α、β− | 21.77年 |
| 228Ac | 232Th(α)→228Ra(β−)→228Ac | β− | 6.15小时 |
| 229Ac | 228Ra(n,γ)229Ra(β−)→229Ac | β− | 62.7分钟 |
| 230Ac | 232Th(d,α)230Ac | β− | 122秒 |
| 231Ac | 232Th(γ,p)231Ac | β− | 7.5分钟 |
| 232Ac | 232Th(n,p)232Ac | β− | 119秒 |
存量及合成
[编辑]
锕元素在地球上十分稀少,只有痕量的227Ac同位素出现在铀矿石中:每吨铀矿石只含有大约0.2毫克的锕。[26][27]227Ac是锕衰变系中的其中一个短暂存在的同位素。该衰变链始于235U(或239Pu),止于稳定同位素207Pb。225Ac则是錼衰变系中短暂存在的同位素。该衰变链始于237Np(或233U),止于近似稳定的209Bi和稳定的205Tl。[28]惟自然界中的錼衰变系早已衰变殆尽,现时地壳中的237Np主要由238U发生核散裂而痕量生成。[29]
含有锕的矿石中也同时含有大量镧及其他镧系元素。然而这些元素的化学、物理特性与锕非常接近,再加上锕含量甚为稀少,因此从矿石中分离出锕元素的做法并不实际,科学家也从未完全分离出锕。[20]锕元素则通常是在核反应炉中用中子照射226Ra产生的,每次产量以毫克计。[27][30]
该反应的锕产量约为镭重量的2%。227Ac可再捕获中子,形成少量的228Ac。合成过后,锕需从镭以及其他的衰变产物中分离出来,这些产物包括钍、钋、铅和铋。第一种分离法使用噻吩甲酰三氟丙酮和苯的混合溶液。调整该溶液的pH值,可从含衰变产物的溶液中萃取出特定的元素(锕需要pH 6.0左右)。[26]另一种分离法是在硝酸中以适当的树脂进行负离子交换法,先把镭和锕与钍分离开来(分离系数为1百万),再用正离子交换树脂和硝酸洗脱液把锕从镭中提取出来(系数为100)。[31]
德国和澳洲的科学家在2000年首次人工合成225Ac。德国超铀元素研究所所使用的是回旋加速器,而澳洲的研究人员则使用位于悉尼圣乔治医院的直线加速器。[32]其合成方法为,对镭-226目标体进行20至30 MeV能量氘离子撞击。这一反应同时会产生半衰期为29小时的226Ac同位素,但由于225Ac的半衰期有10天,所以前者不会对后者造成不纯。225Ac是一种稀有的同位素,在放射线疗法中有潜在的用途。[33]
在1100至1300°C间以锂气体对氟化锕进行还原反应,可以产生锕金属。太高的温度会使产物气化,而太低温则会导致反应不能完全进行。锂的氟化物挥发性比其他碱金属的高,因此最适合用于这一反应中。[9][12]
应用
[编辑]由于存量稀少,价格昂贵,所以锕目前并无重要的工业用途。[9]
227Ac放射性很强,因此有潜力用于放射性同位素热电机中,应用范围包括航天器。227Ac的氧化物和铍压制后可以作为高效能中子源,其活度高于一般的鋂﹣铍和镭﹣铍中子源。[34]这些应用利用的其实是227Ac的衰变产物。进行β衰变后所产生的同位素会释放α粒子,而铍则用于捕获这些α粒子,并放出中子。铍的(α,n)核反应截面较高,因此能高效地将α粒子转换为中子。该反应的公式如下:[35]
227AcBe可用于中子水份仪中,以测量土壤中的水份以及在建造公路时进行湿度、密度的质量检验。[36][37]这类探测仪在测井、中子照相、断层摄影术及其他放射性化学范畴中都有应用的空间。[38]
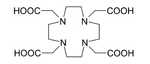
225Ac在医学中用于制造213Bi,[31]或直接作放射线疗法的辐射源。225Ac的半衰期为10天,比213Bi的46小时更适合作放射线治疗。[39]225Ac及其衰变产物所释放的α粒子可以杀死身体内的癌细胞。最大的困难在于,简单的锕配合物经静脉注射进入体内后,会积累在骨骼和肝脏中,并停留数十年。持续的辐射在杀死癌细胞后,会引发新的突变。要避免这种问题,可将225Ac与螯合剂结合,例如柠檬酸、乙二胺四乙酸(EDTA)和二乙烯三胺五乙酸(DTPA)。这可降低锕在骨骼中的积累,但从身体排泄的量仍然不高。改用HEHA[40]或耦合至曲妥珠单抗的DOTA(1,4,7,10-四氮杂环十二烷-1,4,7,10-四羧酸)等螯合剂可以增加锕的排泄量。曲妥珠单抗是一种单株抗体,能够干扰HER2/neu受体。科学家把锕与DOTA结合后注射到老鼠体内,发现疗法有效对抗白血病、淋巴瘤、乳癌、卵巢癌、神经母细胞瘤和前列腺癌。[41][42][43]
227Ac的半衰期为21.77年,可用来研究海水的缓慢垂直混合作用。这种水流的速度大约为每年50米,因此直接测量是无法得到足够的精度的。科学家通过探测各同位素在不同深度的相对比例变化,可以推算出混合作用的发生速率。具体的物理原理如下。海水含有均衡分布的235U。其衰变产物231Pa会慢慢沉淀到海底,所以其浓度会随深度增加,并在一定的深度以下维持恒等。231Pa再衰变成227Ac。混合作用会把海底的227Ac提升上来,因此227Ac的浓度随深度一直增加至海底。科学家分析231Pa和227Ac的浓度﹣深度关系,可以间接研究海水的混合作用。[44][45]
安全
[编辑]227Ac的放射性极强,因此有关的实验都必须在专业实验室的手套箱中进行。当三氯化锕经静脉注射进入老鼠体内后,约33%的锕元素积累在骨骼中,50%进入肝脏。其毒性稍低于鋂和钸。[46]
参考资料
[编辑]- ^ Wall, Greg. C&EN: It's Elemental: The Periodic Table - Actinium. C&EN: It's Elemental: The Periodic Table. Chemical and Engineering News. 2003-09-08 [2013-12-16]. (原始内容存档于2012-03-05).
- ^ 2.0 2.1 2.2 Kirby, Harold W.; Morss, Lester R. Actinium. The Chemistry of the Actinide and Transactinide Elements. 2006: 18. ISBN 978-1-4020-3555-5. doi:10.1007/1-4020-3598-5_2.
- ^ Debierne, André-Louis. Sur un nouvelle matière radio-active. Comptes rendus. 1899, 129: 593–595 [2013-12-16]. (原始内容存档于2014-05-07).
- ^ Debierne, André-Louis. Sur un nouvelle matière radio-actif – l'actinium. Comptes rendus. 1900–1901, 130: 906–908 [2013-12-16]. (原始内容存档于2014-04-26).
- ^ Giesel, Friedrich Oskar. Ueber Radium und radioactive Stoffe. Berichte der Deutschen Chemische Geselschaft. 1902, 35 (3): 3608–3611. doi:10.1002/cber.190203503187.
- ^ 6.0 6.1 Giesel, Friedrich Oskar. Ueber den Emanationskörper (Emanium). Berichte der Deutschen Chemische Geselschaft. 1904, 37 (2): 1696–1699. doi:10.1002/cber.19040370280.
- ^ Debierne, André-Louis. Sur l'actinium. Comptes rendus. 1904, 139: 538–540.
- ^ Giesel, Friedrich Oskar. Ueber Emanium. Berichte der Deutschen Chemische Geselschaft. 1905, 38 (1): 775–778. doi:10.1002/cber.190503801130.
- ^ 9.0 9.1 9.2 Hammond, C. R. The Elements in Lide, D. R. (编), CRC Handbook of Chemistry and Physics 86th, Boca Raton (FL): CRC Press, 2005, ISBN 0-8493-0486-5
- ^ Gilley, Cynthia Brooke; University of California, San Diego. Chemistry. New convertible isocyanides for the Ugi reaction; application to the stereoselective synthesis of omuralide. ProQuest. 2008: 11 [2013-12-16]. ISBN 978-0-549-79554-4. (原始内容存档于2014-01-07).
- ^ Reimers, Jeffrey R. Computational Methods for Large Systems: Electronic Structure Approaches for Biotechnology and Nanotechnology. John Wiley and Sons. 2011-07-20: 575 [2013-12-16]. ISBN 978-0-470-48788-4. (原始内容存档于2014-01-07).
- ^ 12.0 12.1 12.2 12.3 Stites, Joseph G.; Salutsky, Murrell L.; Stone, Bob D. Preparation of Actinium Metal. J. Am. Chem. Soc. 1955, 77 (1): 237–240. doi:10.1021/ja01606a085.
- ^ 13.0 13.1 Actinium, in Encyclopædia Britannica, 15th edition, 1995, p. 70
- ^ Frederick Seitz, David Turnbull Solid state physics: advances in research and applications (页面存档备份,存于互联网档案馆), Academic Press, 1964 ISBN 978-0-12-607716-2 pp. 289–291
- ^ Richard A. Muller. Physics and Technology for Future Presidents: An Introduction to the Essential Physics Every World Leader Needs to Know. Princeton University Press. 2010-04-12: 136 [2013-12-16]. ISBN 978-0-691-13504-5. (原始内容存档于2014-01-07).
- ^ Katz, J. J.; Manning, W M. Chemistry of the Actinide Elements Annual Review of Nuclear Science. Annual Review of Nuclear Science. 1952, 1: 245–262. Bibcode:1952ARNPS...1..245K. doi:10.1146/annurev.ns.01.120152.001333.
- ^ Seaborg, Glenn T. The Transuranium Elements. Science. 1946, 104 (2704): 379–386. Bibcode:1946Sci...104..379S. JSTOR 1675046. PMID 17842184. doi:10.1126/science.104.2704.379.
- ^ 18.0 18.1 18.2 18.3 Actinium. Great Soviet Encyclopedia. [2013-12-16]. (原始内容存档于2013-12-14).
- ^ 19.0 19.1 19.2 Farr, J; Giorgi, A.L.; Bowman, M.G.; Money, R.K. The crystal structure of actinium metal and actinium hydride. Journal of Inorganic and Nuclear Chemistry. 1961, 18: 42. doi:10.1016/0022-1902(61)80369-2.
- ^ 20.00 20.01 20.02 20.03 20.04 20.05 20.06 20.07 20.08 20.09 20.10 20.11 20.12 20.13 20.14 Fried, Sherman; Hagemann, French; Zachariasen, W. H. The Preparation and Identification of Some Pure Actinium Compounds. Journal of the American Chemical Society. 1950, 72 (2): 771. doi:10.1021/ja01158a034.
- ^ 21.0 21.1 Zachariasen, W. H. Crystal chemical studies of the 5f-series of elements. XII. New compounds representing known structure types. Acta Crystallographica. 1949, 2 (6): 388. doi:10.1107/S0365110X49001016.
- ^ Zachariasen, W. H. Crystal chemical studies of the 5f-series of elements. VI. The Ce2S3-Ce3S4 type of structure. Acta Crystallographica. 1949, 2: 57. doi:10.1107/S0365110X49000126.
- ^ 23.0 23.1 23.2 23.3 Meyer, Gerd; Morss, Lester R. Synthesis of lanthanide and actinide compounds. Springer. 1991 [2013-12-16]. ISBN 0-7923-1018-7. (原始内容存档于2014-01-07).
- ^ 24.0 24.1 Zachariasen, W. H. Crystal chemical studies of the 5f-series of elements. I. New structure types. Acta Crystallographica. 1948, 1 (5): 265. doi:10.1107/S0365110X48000703.
- ^ 25.0 25.1 Audi, G.; Kondev, F. G.; Wang, M.; Huang, W. J.; Naimi, S. The NUBASE2016 evaluation of nuclear properties (PDF). Chinese Physics C. 2017, 41 (3): 030001. Bibcode:2017ChPhC..41c0001A. doi:10.1088/1674-1137/41/3/030001.
- ^ 26.0 26.1 Hagemann, French. The Isolation of Actinium. Journal of the American Chemical Society. 1950, 72 (2): 768. doi:10.1021/ja01158a033.
- ^ 27.0 27.1 Greenwood, Norman Neill; Earnshaw, Alan. Chemistry of the elements. 2016: 946. ISBN 978-0-7506-3365-9. OCLC 1040112384 (英语).
- ^ C.M. Lederer; J.M. Hollander; I. Perlman. Table of Isotopes 6th. New York: John Wiley & Sons. 1968.
- ^ Lehto, Jukka; Hou, Xiaolin. Chemistry and Analysis of Radionuclides: Laboratory Techniques and Methodology. Wiley-VCH. 2011: 2–3. ISBN 978-3-527-32658-7.
- ^ Emeleus, H. J. Advances in inorganic chemistry and radiochemistry. Academic Press. 1987-07: 16 [2013-12-16]. ISBN 978-0-12-023631-2. (原始内容存档于2014-01-07).
- ^ 31.0 31.1 Bolla, Rose A.; Malkemus, D; Mirzadeh, S. Production of actinium-225 for alpha particle mediated radioimmunotherapy. Applied Radiation and Isotopes. 2005, 62 (5): 667–679. PMID 15763472. doi:10.1016/j.apradiso.2004.12.003.
- ^ Melville, G; Allen, Bj. Cyclotron and linac production of Ac-225. Applied radiation and isotopes. 2009, 67 (4): 549–55. PMID 19135381. doi:10.1016/j.apradiso.2008.11.012.
- ^ Russell, Pamela J.; Jackson, Paul and Kingsley, Elizabeth Anne Prostate cancer methods and protocols (页面存档备份,存于互联网档案馆), Humana Press, 2003, ISBN 978-0-89603-978-0, p. 336
- ^ Russell, Alan M. and Lee, Kok Loong Structure-property relations in nonferrous metals (页面存档备份,存于互联网档案馆), Wiley, 2005, ISBN 978-0-471-64952-6, pp. 470–471
- ^ Hausner, Henry H. Nuclear Properties. Beryllium its Metallurgy and Properties. University of California Press. 1965: 239.
- ^ Majumdar, D. K. Irrigation Water Management: Principles and Practice (页面存档备份,存于互联网档案馆), 2004 ISBN 978-81-203-1729-1 p. 108
- ^ Chandrasekharan, H. and Gupta, Navindu Fundamentals of Nuclear Science – Application in Agriculture (页面存档备份,存于互联网档案馆), 2006 ISBN 978-81-7211-200-4 pp. 202 ff
- ^ Dixon, W.R.; Bielesch, Alice; Geiger, K. W. Neutron Spectrum of an Actinium–Beryllium Source. Can. J. Phys./Rev. Can. Phys. 1957, 35 (6): 699–702. Bibcode:1957CaJPh..35..699D. doi:10.1139/p57-075.
- ^ Deblonde, Gauthier J.-P.; Abergel, Rebecca J. Active actinium. Nature Chemistry. 2016-10-21, 8 (11): 1084. Bibcode:2016NatCh...8.1084D. ISSN 1755-4349. OSTI 1458479
 . PMID 27768109. doi:10.1038/nchem.2653
. PMID 27768109. doi:10.1038/nchem.2653  (英语).
(英语).
- ^ Improved in Vivo Stability of Actinium-225 Macrocyclic Complexes.
- ^ McDevitt, Michael R.; Ma, Dangshe; Lai, Lawrence T.; et al. Tumor Therapy with Targeted Atomic Nanogenerators (PDF). Science. 2001, 294 (5546): 1537–1540. Bibcode:2001Sci...294.1537M. PMID 11711678. doi:10.1126/science.1064126. (原始内容 (PDF)存档于2011-07-16).
- ^ Borchardt, Paul E.; et al. Targeted Actinium-225 in Vivo Generators for Therapy of Ovarian Cancer (PDF). Cancer Research. 2003, 63 (16): 5084–5090 [2013-12-14]. PMID 12941838. (原始内容 (PDF)存档于2019-07-10).
- ^ Ballangrud, A. M.; et al. Alpha-particle emitting atomic generator (Actinium-225)-labeled trastuzumab (herceptin) targeting of breast cancer spheroids: efficacy versus HER2/neu expression. Clinical cancer research : an official journal of the American Association for Cancer Research. 2004, 10 (13): 4489–97. PMID 15240541. doi:10.1158/1078-0432.CCR-03-0800.
- ^ Nozaki, Yoshiyuki. Excess 227Ac in deep ocean water. Nature. 1984, 310 (5977): 486. Bibcode:1984Natur.310..486N. doi:10.1038/310486a0.
- ^ Geibert, W.; Rutgers Van Der Loeff, M.M.; Hanfland, C.; Dauelsberg, H.-J. Actinium-227 as a deep-sea tracer: sources, distribution and applications. Earth and Planetary Science Letters. 2002, 198: 147. Bibcode:2002E&PSL.198..147G. doi:10.1016/S0012-821X(02)00512-5.
- ^ Langham, W.; Storer, J. Toxicology of Actinium Equilibrium Mixture. Los Alamos Scientific Lab.: Technical Report. 1952. doi:10.2172/4406766.
外部链接
[编辑]- 元素锕在洛斯阿拉莫斯国家实验室的介绍(英文)
- EnvironmentalChemistry.com —— 锕(英文)
- 元素锕在The Periodic Table of Videos(诺丁汉大学)的介绍(英文)
- 元素锕在Peter van der Krogt elements site的介绍(英文)
- WebElements.com – 锕(英文)
- NLM Hazardous Substances Databank – Actinium, Radioactive (页面存档备份,存于互联网档案馆)
- Actinium in Haire, Richard G. Morss; Edelstein, Norman M.; Fuger, Jean , 编. The Chemistry of the Actinide and Transactinide Elements 3rd. Dordrecht, The Netherlands: Springer. 2006. ISBN 1-4020-3555-1.




![{\displaystyle \mathrm {^{226}_{\ 88}Ra\ +\ _{0}^{1}n\ \longrightarrow \ _{\ 88}^{227}Ra\ {\xrightarrow[{42.2\ min}]{\beta ^{-}}}\ _{\ 89}^{227}Ac} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/4dd2b4987fcb112ca3470fd49444e59bf387b0ca)
