路易斯结构


路易斯结构(英语:Lewis structures),又称路易斯点图像、电子点图像、路易斯电子点式、路易斯点结构、电子点结构,是分子中原子和原子键结和标示孤对电子存在的图像。[1][2][3] 路易斯结构可以画出表示分子中的共价键以及配位化合物。
路易斯结构是以美国物理化学家吉尔伯特·路易斯(Gilbert Newton Lewis)的名字命名,他在1916年时把路易斯结构写入它的一篇名为《原子和分子》的文章中。[4] 他们类似电子点图像在价电子和孤对电子中以点来表示,但也可以用线来表示共享电子(如单键、双键、三键等)。
路易斯结构中每个原子他们的位置在分子的结构上用不同的化学记号标示。线画在原子和原子间的键结(也可以用一对点来表示),多馀的电子以一对点来表示孤对电子。虽然第二周期的主族元素可反应借由获得或失去共享电子让外层价电子填满至8个,然而其他元素对于价电子遵循不同的规则。氢原子(H)的遵循方式是填满最外层的一个价电子或使之最外层没有电子,但过渡金属遵循dectet (12) [5]规则(例如过锰酸盐离子)。
结构
[编辑]数电子
[编辑]路易斯结构中的电子总数等于每个原子价电子的总数,非价电子不会出现在路易斯结构中。
一旦电子的总数被决定,电子必须排进结构中,一开始须排入孤对电子:一对点为一对孤对电子。孤对电子一开始需排在外层原子(氢原子除外),直到外层被键结或孤对电子填满八颗,多出来的孤对电子要排在中心原子。当不确定时,孤对电子要先排在电负度高的原子。
一旦孤对电子排进原子,尤其是中心原子可能不会外层有八颗电子,在此情况下,原子必须组成共价键(孤对电子的移动形成第二个原子间的化学键结),当原子共享电子对时,仍然符合八隅体规则。一个共价键对一个原子表示有两个外层电子。
路易斯结构对于多原子离子的画法也是一样,数电子时,阴离子需要多画电子在其结构中,阳离子则须比中性状态时少画电子。
画路易斯结构时,如果有离子键则此个结构需要用括号标示,若有电荷则要画在括号的右上方。
这里有一个不用数电子而可以画路易斯结构的方法:先画原子和其价电子,配对其价电子形成键结,阴离子或阳离子则增加或去掉电子[6]。
数价电子的小方法,数需要多少价电子能填满符合八隅体规则(氢原子只有两颗电子),然后把两个原子算出的答案相加,就是形成键结的电子数,剩下的电子必须去填满其他原子,使之符合八隅体规则。
其他一般和简单的步骤来画路易斯结构和共振结构已经被提出来了。[7]
在步骤开始前必须先了解分子的几何结构,也就是不论它是不是环状结构(每个原子彼此连接),很多画出简单或复杂的路易斯结构方法可以在Chem-Net网站中找到。[8]
形式电荷
[编辑]在形式电荷这个术语当中描述对照和评定相似的共振结构[9],是他们原子的电荷量(路易斯结构中电子数量)假设没有共价键或非极性共价键。这用在电子可能重新配置而需要了解其反应机转的时候,不过常常有其partial charge相同的时候,此时例外。简单来讲,形式电荷有它的公式,以下是假设:
说明:
- 是形式电荷
- 代表原子价电子的数量
- 代表未共享的电子数量
- 代表原子间键结电子的数量
形式电荷是计算路易斯结构中中性电荷的原子其价电子数的差异。电子在原子共价键当中是同等的被分开。离子的形式电荷总数须要和它的价数相等,还有中性分子的形式电荷必须为零。
共振
[编辑]主条目:共振 (化学)
有些分子或离子,很难决定其孤对电子是否要形成双键或三键,这种状况有时发生在很多相同型态原子围绕中心原子,常看到发生在多原子离子。
当这种情况发生,此路易斯结构称做共振结构,此结构的情况有很多重复的,其分子的路易斯结构是这多种结构的平均状态。
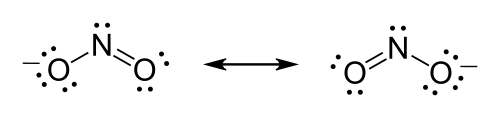
例如硝酸离子(NO3−)大部分都是双键在氮和氧原子中间来满足其氮原子的八隅体规则,但由于此结构不对称,所以不一定哪个氧原子是接双键,此时有三种可能的共振结构。用路易斯结构来表示共振的方式为画出其可能共振结构,其中双键转换的方向用箭头表示。
当比较完相同分子的共振结构后,常常拥有最少形式电荷的会贡献形式电荷到整个共振化合物,当形式电荷对共振结构很重要时,其负电荷会喜欢在电负度高的原子上,而正电荷会喜欢在电负度低的原子上。
像六氟化硫这种超价分子,其单键也可以移动,他的解释是基于量子化学而不是一般的扩大八隅体模型。
例子
[编辑]亚硝酸根的化学式是NO2−
- 氮原子是其中电负度最低的原子,所以为中心原子。
- 数数看他们的价电子,氮原子有5个价电子;两个氧是6个价电子,价电子总数是 (6 × 2) + 5 = 17。此离子带-1价,表示有多馀的电子,所以电子总数是18。
- 排进孤对电子。每个氧原子必须和氮原子键结,也就是四个电子(两个为一键结)。剩下的14个电子先当他们是孤对电子。一个氧原子最多能有三对孤对电子,让每个氧原子加上键结总共有八颗电子(六个孤对电子加两个成键电子)。剩下的两个孤对电子则排进氮原子中。
- 要满足八隅体规则。所有的氧原子目前被分配到8颗电子,氮原子只被分配到6颗(而需要8颗),所以其中一个氧原子的孤对电子需要形成双键,但其他的原子也会有相同的情况,所以必须要有共振结构。
- 总结,两个路易斯结构必须都画:每一个结构其中一个氧原子要与氮原子行双键键结。第二个氧原子在结构中将与氮原子行单键键结。每个结构都要画上括号并在括号的右上方附上(−),在两个共振结构中间画上双头箭号表示之。
替代表示方式
[编辑]


化学的结构可以被书写得更简单,特别是在表示有机化合物时。简化结构式,几乎或所有的共价键会被移除,用相同基团写在一起彼此相连表示。
另一个简化的结构是骨架结构式,其键结用线表示,碳-碳键不会标示出来,而是用转折点表示。氢原子与碳键结则不会表示出来(氢原子可以看有几个碳推算出数目),如图表示,只显示碳与碳之间的键结,没有显示氢与碳之间的键结。
有些结构用路易斯结构过于复杂,故使用3D结构表示,如空间填充图像。
另见
[编辑]参考文献
[编辑]- ^ IUPAC definition of Lewis formula. [2013-07-09]. (原始内容存档于2016-11-30).
- ^ Zumdahl, S. (2005) Chemical Principles Houghton-Mifflin (ISBN 0-618-37206-7)
- ^ G.L. Miessler, D.A. Tar, Inorganic Chemistry 2nd, Pearson Prentice–Hall, 2003, ISBN 0-130-35471-6
- ^ Lewis, G. N., The Atom and the Molecule, J. Am. Chem. Soc., 1916, 38: 762–85, doi:10.1021/ja02261a002
- ^ Weinhold, Frank; Landis, Clark R. Valency and bonding: A Natural Bond Orbital Donor-Acceptor Perspective. Cambridge: Cambridge University Press. 2005: 381–383. ISBN 0-521-83128-8.
- ^ Miburo, Barnabe B., Simplified Lewis Structure Drawing for Non-science Majors, J. Chem. Educ., 1993, 75 (3): 317, doi:10.1021/ed075p317
- ^ Lever, A. B. P., Lewis Structures and the Octet Rule, J. Chem. Educ., 1972, 49 (12): 819, doi:10.1021/ed049p819
- ^ Chemistry Net Link (页面存档备份,存于互联网档案馆)
- ^ Miessler, G. L., Tar, D. A., (2003), p. 53 – Explanation of formal charge usage.





