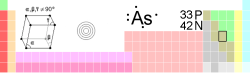
User:Blaster~zhwiki/翻譯中:砷
| |||||||||||||||||||||||||||||||||||||||||||
| 总体特性 | |||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 名称, 符号, 序号 | 砷、As、33 | ||||||||||||||||||||||||||||||||||||||||||
| 系列 | 类金属 | ||||||||||||||||||||||||||||||||||||||||||
| 族, 周期, 元素分区 | 15族(VA), 4, p | ||||||||||||||||||||||||||||||||||||||||||
| 密度、硬度 | 5727 kg/m3、3.5 | ||||||||||||||||||||||||||||||||||||||||||
| 颜色和外表 | 金属灰色
| ||||||||||||||||||||||||||||||||||||||||||
| 地壳含量 | 6×10-4 % | ||||||||||||||||||||||||||||||||||||||||||
| 原子属性 | |||||||||||||||||||||||||||||||||||||||||||
| 原子量 | 74.92160 原子量单位 | ||||||||||||||||||||||||||||||||||||||||||
| 原子半径(计算值) | 115(114)pm | ||||||||||||||||||||||||||||||||||||||||||
| 共价半径 | 119 pm | ||||||||||||||||||||||||||||||||||||||||||
| 范德华半径 | 185 pm | ||||||||||||||||||||||||||||||||||||||||||
| 价电子排布 | [氩]3d104s24p3 | ||||||||||||||||||||||||||||||||||||||||||
| 电子在每能级的排布 | 2,8,18,5 | ||||||||||||||||||||||||||||||||||||||||||
| 氧化价(氧化物) | 3,-3,5(弱酸性) | ||||||||||||||||||||||||||||||||||||||||||
| 晶体结构|菱面体晶 | |||||||||||||||||||||||||||||||||||||||||||
| 物理属性 | |||||||||||||||||||||||||||||||||||||||||||
| 物质状态 | 固态 | ||||||||||||||||||||||||||||||||||||||||||
| 熔点 | 1090 K(817.2 °C)(27.5倍大气压) | ||||||||||||||||||||||||||||||||||||||||||
| 沸点 | 887 K(613.8 °C)(升华) | ||||||||||||||||||||||||||||||||||||||||||
| 摩尔体积 | 12.95×10-6m3/mol | ||||||||||||||||||||||||||||||||||||||||||
| 汽化热 | 34.76 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||
| 熔化热 | 369.9 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||
| 1.3×10-9帕(323K) | |||||||||||||||||||||||||||||||||||||||||||
| 声速 | 无数据 | ||||||||||||||||||||||||||||||||||||||||||
| 其他性质 | |||||||||||||||||||||||||||||||||||||||||||
| 电负性 | 2.18(鲍林标度) | ||||||||||||||||||||||||||||||||||||||||||
| 比热 | 330 J/(kg·K) | ||||||||||||||||||||||||||||||||||||||||||
| 电导率 | 3.45×106/(米欧姆) | ||||||||||||||||||||||||||||||||||||||||||
| 热导率 | 50 W/(m·K) | ||||||||||||||||||||||||||||||||||||||||||
| 第一电离能 | 947.0 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||
| 第二电离能 | 1798 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||
| 第三电离能 | 2735 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||
| 第四电离能 | 4837 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||
| 第五电离能 | 6043 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||
| 第六电离能 | 12310 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||
| 最稳定的同位素 | |||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||
| 在没有特别注明的情况下使用的是 国际标准基准单位单位和标准气温和气压 | |||||||||||||||||||||||||||||||||||||||||||
砷 (英文:arsenic,发音为/ˈɑrsnɪk/ or /ɑrˈsɛnɪk/ 再化合物中或當形容詞時])是一個知名的化學元素,元素符號As,原子序 33。第一次有關砷的紀錄是在1250年,由大阿爾伯特所完成。[1] 原子量是74.92。它是一種以有毒著名的類金屬,並有許多的同素異形體,黃色(分子結構,非金屬)和幾種黒、灰色的(類金屬)是一部份常見的種類。三種有著不同晶格結構的類金屬形式砷存在於自然界(砷礦sensu stricto,和更為稀有的自然砷鉍礦和輝砷礦,但更容易發現的形式是砷化物與砷酸鹽化合物,總共有數百種的礦物是已被發現的。砷與其化合物被運用在農藥、除草劑、殺蟲劑與許多種的合金中。
歷史
[编辑]Arsenic這個字源自於波斯語زرنيخ Zarnikh,意思是"黃色的雌黃". Zarnikh 又源自於希臘語的arsenikon和一個類似的希臘字"arsenikos",意思是陽性的或有權勢的。砷化合物(雄黃、雌黃)在遠古即被人所認識與使用。[2]由於砷中毒的症狀模糊不清,因此曾經被大量用於謀殺,直到馬希氏實驗,一個很準確測知砷存在的實驗,出現為止。(另一種比較不敏銳但較為普遍的測試是賴因什測驗。)由於砷被統治階層使用於互相謀殺與它的隱密性,砷也被稱作"國王用的毒藥"和"毒藥之王"。[3]
在青銅器時代,砷通常是摻雜在青銅裡,這樣可以使合金更為堅硬。(此種合金也稱作"含砷青銅"。)大阿爾伯特(1193–1280)被認為是在1250年第一個分離出此種元素的歐洲人,方法是把肥皂與三硫化二砷共熱。[1]1649年,Johann Schröder發表了兩種製備砷的方法。
卡戴特的發煙液體 (不純的二甲基砷),第一個有機金屬化合物,被卡戴特利用乙酸鉀與三氧化二砷的反應合成出來。[4]
在維多利亞時代,"砷" (無色晶體,可溶於水的白色三氧化二砷)與醋和白堊石混和之後,然後給女人吃,使她們的皮膚更白,以表明她們並沒有在田裡工作。砷也被女性塗抹在她們的臉與手臂上以"加強她們的膚色"。一次在食物中摻雜了砷的意外導致了1858年的布拉福甜品中毒事件,導致了20人左右死亡,以及約200人因此生病。[5]
性質
[编辑]同位素
[编辑]自然界中存在的砷只有一種同位素,75As。[6]在2003年,至少有33種的放射性同位素被製造出來,原子量從60到92都有。其中最穩定的是73As,半衰期80.3天。比穩定的75As衰變時傾向發生β+衰變,而那些比較重的則傾向β-衰變,但還是有些例外。
至少有十種核異性體已經被發現,原子量自66到84。其中最穩定的是68mAs,半衰期為111秒。 [6]
同素異形體
[编辑]
像磷,砷是一個極佳的範例,展現一個元素有多種的同素異形體,因為它的各種同素異形體有著截然不同的性質,最常見的同素異形體有灰色類金屬、黃砷與黑砷。[7]
砷的最常見同素異形體是灰砷,它的結構與黑磷(β-金屬性磷)相似,並有類似石墨的分層的晶體結構。 它是由許多個由六個元素環起來的環狀結構,環與環之間也有連接。每個原子與同一層中三個相鄰的原子鍵結,並且與上層跟下層各三個的砷原子相吸引。這種相對來說比較密的結構導致他擁有5.73 g/cm3的高密度。[8]
黃砷 (As
4)是軟而且像臘的,不像P
4。兩者皆是由四個原子組成一個正四面體的架構,其中每個原子都與其他三個原子以單鍵連接,使得它的鍵結有相當程度的扭曲導致它不安定。這種型態與其它型態相比是最不穩定、活性最強、較易揮發、密度較小和毒性更強的。黃砷的製造方法是把砷蒸氣放入液態氮中快速冷卻,它在光照下會迅速轉變成灰砷,此型態的密度是1.97 g/cm³。[8]
黑砷的結構與紅磷相近。[8]
化學性質
[编辑]砷最常見的氧化數是−3 (砷化物:通常是類似合金的與金屬間的化合),+3 (砷離子(III),或亞砒酸鹽,與大部分的有機砷化合物),與+5 (砷酸鹽類: 最穩定的非有機砷氧化合物)。砷也會很快速的自我鍵結,出現 Arsenic also bonds readily to itself, forming 方型的As3−
4離子,存在於含砷的方鈷礦裡。當為+3氧化數時。砷的立體結構會因為有孤對電子而受影響。
砷的化學性質與和他同一族的元素磷相近。就像磷一樣,它可以化合出無色、無臭、結晶型的氧化物三氧化二砷與五氧化二砷,這兩種化合物皆可潮解且在水中的溶解度極高並生成酸性化合物。砷酸是一種弱酸。它也像磷一樣可以產生一種不穩定的氣態化合物,砷化氫 (AsH3)。它們之間的相似性非常的高,以至於砷有時候會取代磷進行生化反應,導致砷中毒。但是,在劑量不至於中毒的情況下,可溶解的砷化合物被用作興奮劑,並且曾經在18世紀時以很少的劑量當作藥品來使用。[9]
當在空氣中加熱時,砷被氧化成三氧化二砷,在反應中產生的蒸汽,有種很類似蒜的氣味。此種蒸氣可以在用槌子敲打砷黄鐵礦的時候被發現。砷(和一些砷化合物)在一大氣壓下加熱會昇華,直接從固體成為氣體,跳過液體這一階段。液態出現在20大氣壓或以上,這也說明了為什麼它的熔點會高於沸點。[8]
化合物
[编辑]砷的化合物在許多方面與磷的化合物相近,因為磷與砷在周期表是屬於同一族。
最重要的砷化合物是三氧化二砷As2O3,黃色的硫化物雌黃 (As2S3)、紅色的雄黃(As4S4)、巴黎綠、砷酸鈣與砷酸氫鉛。後面三個被用作農藥、殺蟲劑與毒物。
三氧化二砷製備於砷的氧化,五氧化二砷的製備法是砷酸脫水。這兩種化合物皆會在強鹼中分解,並分別產生亞砷酸根AsO3−
3 與砷酸根AsO3−
4。這種在砷酸根與砷酸之間的質子傳遞與磷酸與磷酸根之間發生的非常類似,但是,砷酸與砷酸根中的砷是與三個氧原子鍵結,而沒有與氫原子鍵結,不像亞磷酸根與亞磷酸,他們包含了不具酸性的P-H鍵結。亞砷酸是一個三質子酸,但亞磷酸不是。
有非常多種砷硫化物是廣為人知的,包括As4S3、As4S4、As2S3與As4S10。所有的亞砷鹵化物(不包括與砈化合)是已知且穩定的。但砷鹵化物的情況則不一樣,在室溫下只有五氟化砷是穩定的,五氯化砷只有在50 °C以下是穩定的,五溴化砷和五碘化砷還未被發現。[9]
砷被當作第五族元素而使用在III-V半導體化合物。當矽的性能不適用而且可以接受更高的價格時,砷化鎵、砷化銦與砷化鋁被拿來當作半導體材料。
- 砷酸 (H3AsO4)
- 亞砷酸 (H3AsO3)
- 三氧化二砷 (As2O3)
- 砷化氫 (Arsenic Trihydride AsH3)
- 砷化鎘 (Cd3As2)
- 砷化鎵 (GaAs)
- 砷酸氫鉛 (PbHAsO4)
砷也有一種+2的氧化數,出現在As4S4,雄黃。可以存在的原因是可以把兩個砷原子配對製成二正陽離子[As-As]2+,所以砷的價數還是三。[10]
產處
[编辑]
砷黃鐵礦,俗稱毒砂,[11] (FeAsS)是最常見的含砷礦物。 在岩石圈中,大部分含砷礦物的化學式是M(II)AsS,M(II)大部分的情況是Fe、Ni或Co。

雌黃與雄黃曾被用來當作繪圖用的顏料,但他們因為他們的毒性與過於活潑而被淘汰。雖然砷有時候會被發現自然存在,但比較經濟的來源仍是之前提到的砷黃鐵礦。它還可以以金屬(如銀、鈷與鎳)砷硫化物的形態被發現。(輝砷鈷礦:CoAsS與方鈷礦CoAs3)還有以砷酸礦的情況存在,如黃鉛礦:Pb5(AsO4)3Cl與鈷華:Co3(AsO4)2. 8H2O,與更為少見的亞砷酸礦。
除了上面提到的非有機形式外,砷也以許多種有機化合物的形式存在於自然界。 [12]
生產
[编辑]
根據英國地質調查局與美國地質調查局,2005年,白砷的最大生產國是中國,囊括了接近全球產量的50%,接下來是智利、秘魯與摩洛哥 [13]這些砷大部分是由開採得到,例如秘魯的生產多半來自於銅的開採,而中國則來自金的開採。砷是金礦、銅礦與鉛礦精練的副產品。[14]
在有空氣的環境烘烤砷黃鐵礦的過程中,砷以三氧化二砷的形式昇華,留下鐵氧化物。當在無氧的環境時,會產生出類金屬砷。當在硫或其他物質中提煉砷時,人們讓它在真空或純氫大氣中昇華或在熔融的砷鉛混合物中把它蒸餾出來。[12][15]
用途
[编辑]木材處理
[编辑]砷對昆蟲、細菌與蕈類有極大的毒性,使得它成為處理木材的理想物質,全世界使用的鉻酸銅砷,縮寫為CCA,又稱防腐鹽,自1950年代將之工業化生產後,是砷的消耗中,比例佔最大的。但由於砷造成的環境問題,大部分的國家已將其禁用,最先禁用的國家是歐盟與美國,在2004年實施。[16][17]
在2002年,19600公噸的砷化合物中的九成都拿來處理木材,在2007年,仍有5280公噸的化合物中的一半被拿來處理木材。[14][18]在歐盟,根據美國環境保護局的網站,自2003年12月31日,用CCA處理的木材不再被用來建造居住或公共用建築,而改由ACQ、硼酸鹽、銅唑類、環克座與普克利之類的替代處理方法。
雖然被停用了,使用砷處理過的木材的處理問題是大眾最關注的議題之一,大部分比較舊的而被處理過的木材是使用CCA處理的,用CCA處理的木材仍在大部份的國家被廣泛使用,並且曾在20世紀後半被大量的當作建材使用。雖然大部分的國家在一些研究顯示砷可能從木材中洩漏而進入附近的土壤中(例如從遊樂器材中)後將其禁用,這種風險也存在於燃燒用CCA除裡的木材中,直接或間接的攝取到燃燒CCA木材的灰燼造成了許多動物的死亡與一些人嚴重的中毒。人類的致死劑量約20 克的灰燼。一些建地或拆除地裡的CCA木材可能不慎的被燃燒。廢棄的CCA木材的處理法並沒有全世界一致的標準,而有些人對現在通行的掩埋法有意見。[19]
藥物
[编辑]
在18、19、20世紀,一部份的砷化合物被當作藥物使用,包括阿斯凡納明(被保羅·埃爾利希使用)與三氧化二砷(被湯瑪士·弗勒所使用)。 阿斯凡納明與新砷凡納明曾是梅毒與錐蟲病的藥方,但後來被抗生素所取代。 三氧化二砷500年被應用於各種領域,但最主要是用於治療癌症。在2000年,美國食品藥品監督管理局同意把此種化合物開給得急性早幼粒細胞白血病並對維A酸有抗藥性的病人。[20]它也被弗勒用來治療牛皮癬。[21]最近有針對砷-74(一個正子發射者)的研究,使用這整銅維素的好處是,在正電子發射計算機斷層掃描時它的訊號比原先使用的碘-124清楚,因為碘傾向於往甲狀腺聚集,導致不少的雜訊。[22]
顏料
[编辑]醋酸亞砷酸銅曾被用來當作綠色顏料,並有許多不同的俗名。包括'巴黎綠'與'寶石綠',它導致了不少的砷中毒。舍勒綠一種亞砷酸銅,曾在十九世紀用來當作在甜品內的食用色素。[23]
軍事
[编辑]一次世界大戰後,美國儲存了20,000 噸的路易氏劑,一種化學武器,是其中的糜爛劑並會刺激肺。這些存貨在1950年代後被用漂白劑無效化並被倒入墨西哥灣。[24]在越戰期間,美國使用了藍色枯葉劑(二甲砷酸)作為彩虹除草劑的一種,防止北越得到珍貴的糧食作物。
其他用途
[编辑]- 許多種農業用殺蟲劑、去籽劑與毒藥。例如砷酸氫鉛曾於20世紀當作果樹用殺蟲劑。[25]它的使用有時候會導致使用噴霧劑的人的腦受損,近半個世紀以來,甲基砷酸鈉(MSMA)與甲基砷酸二鈉(DSMA),比較不毒的有機砷化物取代了砷酸鹽在農業的角色。
- 在動物的飼料裡,特別在美國是防治疾病[26] (第5.3節,第310頁)與刺激生長的一個方法。一個例子是在1995黏製2000年,洛克沙砷曾佔了嫩雞幼年與成長飼料中的69.8%與73.9%。[27]
- 砷化鎵是一種重要的半導體材料,使用在積體電路中,使用這種材料的積體電路速度比用矽的快的多(但也比用矽的貴的多)。不像砷,它是使用直接遷移,所以可以用在雷射二極體與LED中,把電能直接轉成光能。
- 也被用在表面鍍銅與煙火製造。
- 接近2%的砷被用來製造鉛合金,用於鉛彈與子彈。[28]
- 少量的砷備加入黃銅,使之可以抵抗脫鋅,這種等級的黃銅被用來製造水管配線。
生物中的角色
[编辑]

非有機的砷與其化合物,在進入食物鏈後,會經由甲基化反應逐漸代謝成比較不毒的形式。舉例來說,en:Scopulariopsis brevicaulis這種黴菌在有無機砷的環境哩,會製造出數量可觀的三甲基砷。[29]有機化合物砷酸甜菜鹼存在於許多的海鮮中,如魚和海藻,在香菇中的濃度也不低。一般人平均的攝取量是每天10–50微克,如果常吃魚與香菇的化,吸收1000毫克的量也不會不正常。它的危險性不高,因為此化合物的毒性幾乎是沒有的。[30]
一些種類的細菌藉由氧化各種的燃料以獲取能量,但也同時將砷酸鹽還原成亞砷酸鹽,反應所使用的酶被稱做砷酸還原酶。(Arr)
2008年,有些細菌被發現會在無氧的情況行光合作用,他們使用砷來當作電子供給者,產生砷酸鹽(就像一般光合作用使用水來提供電子,產生元素氧)。科學家推測,以前,此種光合作用菌產生了砷酸鹽,使得還原砷酸鹽的細菌得以存活。一種叫PHS-1的品種被分離出來,因為它與一種γ-變形菌,節外硫紅螺菌有關。它的機制尚未明朗,但一種已被編碼的砷酸還原酶可能會與它同源的酶有相反的功能。[31]
安全
[编辑]
砷與它的許多化合物為超強的毒藥,砷會經由許多機制干擾ATP的合成,在三羧酸循環中,砷會阻礙丙酮酸脫氫酶,並藉由與其競爭磷酸根來分離氧化磷酸化,造成與能量相關的NADH還原、粒線體呼吸作用與ATP合成被干擾。過氧化氫的生產量也會增加,可能會導致它產生出活性強的氧化合物與有氧化力的化合物。這些新城代謝的干擾會由細胞壞死,非細胞凋亡導致多重器官衰竭導致死亡。解剖的話會發現許多磚紅色的黏膜,產生的原因是嚴重出血。雖然砷會導致中毒,但它也可以當作保護的角色。[32]
在歐盟,en:directive 67/548/EEC將元素砷與其化合物被歸類於"有毒的"與"對環境有危害的" 國際癌症研究機構(IARC)將砷與其化合物歸類於第一類致癌物質,而歐盟也將三氧化二砷、五氧化二砷與砷酸鹽歸類於第一類致癌物質。 砷出現在飲用水裡會導致砷中毒,其中最常見的是砷酸鹽[HAsO42- ; As(V)]與亞砷酸[H3AsO3 ; As(III)]。砷有能力自由的在+3氧化態與+5氧化態來回轉換,導致他在自然界中的來源更多。根據克羅、各羅尼克、瑪拉傷與紐曼,了解什麼可以促進+3價砷氧化或限制+5價砷還原對在被汙染的地方使用生物降解法有很大的幫助。研究氧化三價砷的化學無機自營菌與異營的五價砷還原菌可以幫助了解砷的氧化還原。[33]
治療慢性砷中毒的技術已經十分成熟,開藥的第一天,英國的抗路易氏劑(重金屬結合劑)會以5至300毫克每公斤的劑量,每四小時服用一次開給病人,第二天則是相同的劑量,但是改成每六小時服用一次,接下來的八天則是每八小時服用一次。[34]
飲用水中的砷
[编辑]出現在地面水中的砷曾經造成孟加拉與鄰近國家的大規模砷中毒。[35]目前全世界主要有42個發現地表水中含有砷的個案,估計有接近5700萬人飲用的地表水中所含的砷超過WHO所規定的10ppb標準。但是,根據一個台灣的研究,製癌機率要顯著的提升,砷的濃度要到達150ppb。[36]這些出現在地表水中的砷的來源是天然的,它們是從土壤中水面下缺氧的環境中釋放出來的。這些地表水在一些當地與西方的非官方組織與孟加拉政府在20世紀末所主持的飲用水井計畫後開始被拿來使用。這項計畫是設計來以免用來飲用的水受到細菌的汙染,但並沒有成功的檢測出在地表水中的砷。許多其他南亞、東南亞的國家與地區,如越南、柬埔寨與中國擁有產生高砷水的地理環境。泰國的那空是貪瑪叻在1987年傳出砷中毒,並且溶解有砷的昭拍耶河被懷疑含有高含量的自然溶解的砷,但由於瓶裝水的使用,並沒有造成公共衛生問題。[37]
在美國北部,包括部分的密西根州、威斯康辛州、明尼蘇達州與達科他州的地表水中都含有高含量的砷,在威斯康辛州,皮膚癌機率的升高被認為與暴露在有砷的環境中有關,即使是在那些飲用水含砷低於10ppb標準的地區也如此。[38]
在智利出現的流行病學證據說明了一個在長期暴露在砷中的環境與不同種類的癌症有劑量上的關係,尤其是在其他危險因子,如抽菸,也同時出現的時候。這些效果已被證明在濃度50ppb以下時仍會存在。[39]
分析許多關於暴露在非有機砷的環境中的研究,可以發現在10ppb的環境下,膀胱癌的有微小但可量測出來的風險提升。[40]根據劍橋大學地理學系的彼得·雷芬史考羅夫特,[41]全世界接近8000萬人藉由喝水吸收10到50ppb的砷,假如它們全部都剛好藉由飲水吸收10ppb的砷,前述的分析將會推測灰因為單獨這個因素而多出2000例的膀胱癌病例,這很明顯的是低估了整體的影響。由於它並沒有計算皮膚癌與肺癌,還明顯的低估了暴露量,居住在砷含量高過於WHO標準的人應該好好衡量一下改善砷含量的好處與代價。
砷可以藉由與含鐵礦物的共沉作用,步驟有氧化與過濾,來從飲用水中移除。當這個方法失敗時,人們就會利用化學吸附來去除砷。許多種化學吸附的方法,在一個由國家科學基金會與美國國家環境保護局所進行的研究中被證明是有效的。一群由貝爾法斯特皇后大學的不哈斯客博士所帶領的印度與歐洲工程師在西孟加拉設立了六座砷處理場,它們使用的是適合當地的方法。這項科技並不會用到任何化合物,砷則在地下水層中轉變為不溶於水的物質,方法是把曝氣過的水重新導入地下水層中,這種方法不會產生任何的廢棄物,而且一塊美金約可處理十立方公尺的水。[42]
在磁力梯度極低的地方,已經證明可以用磁力來分離砷。此法可以在表面附近製造出一層磁鐵礦(Fe3O4)的奈米晶體。使用這種方法可以大量減少從水中移除砷所產生的廢棄物。[43]
流行病學的研究認為長期吸收在飲用水中的砷與2型糖尿病可能有所關聯,但還沒有辦法提出有力的證據來證明其關聯性。
工作上的接觸
[编辑]使用無機砷與其化合物的工廠如木材處理工廠、玻璃製造工廠、不含鐵的金屬合金與半導體製造。無機砷也在焦爐的殘餘物中被偵測出來。工作中的接觸與中毒可能會出現在這些工廠上班的人身上。[44]
參見
[编辑]參考資料
[编辑]- ^ 1.0 1.1 Emsley, John. Nature's Building Blocks: An A-Z Guide to the Elements. Oxford: Oxford University Press. 2001: 43,513,529. ISBN 0-19-850341-5.
- ^ Bentley, Ronald; Chasteen, Thomas G. Arsenic Curiosa and Humanity (PDF). The Chemical Educator. 2002, 7 (2): 51. doi:10.1007/s00897020539a. 已忽略未知参数
|do=(帮助); - ^ Vahidnia, A; Van, Der, Voet, Gb; De, Wolff, Fa. Arsenic neurotoxicity--a review.. Human & experimental toxicology. 2007, 26 (10): 823–32. ISSN 0960-3271. PMID 18025055. doi:10.1177/0960327107084539. 已忽略未知参数
|month=(建议使用|date=) (帮助) - ^ Seyferth, Dietmar. Cadet's Fuming Arsenical Liquid and the Cacodyl Compounds of Bunsen. Organometallics. 2001, 20 (8): 1488–1498. doi:10.1021/om0101947.
- ^ Turner, Alan. Viewpoint: the story so far: An overview of developments in UK food regulation and associated advisory committees (PDF). British Food Journal. 1999, 101 (4): 274–283. doi:10.1108/00070709910272141.
- ^ 6.0 6.1 Georges, Audi. The NUBASE Evaluation of Nuclear and Decay Properties. Nuclear Physics A (Atomic Mass Data Center). 2003, 729: 3–128. doi:10.1016/j.nuclphysa.2003.11.001.
- ^ Norman, Nicholas C. Chemistry of Arsenic, Antimony and Bismuth. Springer. 1998: 50. ISBN 9780751403893.
- ^ 8.0 8.1 8.2 8.3 Holleman, Arnold F.; Wiberg, Egon; Wiberg, Nils;. Arsen. Lehrbuch der Anorganischen Chemie 91–100. Walter de Gruyter. 1985: 699–672. ISBN 3110075113 (German).
- ^ 9.0 9.1 Holleman, Arnold F.; Wiberg, Egon; Wiberg, Nils;. Arsen. Lehrbuch der Anorganischen Chemie 91–100. Walter de Gruyter. 1985: 675–681. ISBN 3-11-007511-3 (German).
- ^ Arsenic: arsenic(II) sulfide compound data. WebElements.com. [2007-12-10].
- ^ King, R. J. Minerals explained 35: Arsenopyrite. Geology Today. 2002, 18 (2): 72–75. doi:10.1046/j.1365-2451.2002.t01-1-00006.x.
- ^ 12.0 12.1 Matschullat, Jörg. Arsenic in the geosphere — a review. The Science of the Total Environment. 2000, 249: 297–312. doi:10.1016/S0048-9697(99)00524-0. 已忽略未知参数
|issues=(帮助) - ^ 13.0 13.1 Brooks, William E. Mineral Commodity Summaries 2007: Arsenic (PDF). United States Geological Survey. [2008-11-25].
- ^ 14.0 14.1 Brooks, William E. Minerals Yearbook 2007: Arsenic (PDF). United States Geological Survey. [2008-11-08].
- ^ Whelan, J. M.; Struthers, J. D.; Ditzenberger, J. A. Separation of Sulfur, Selenium, and Tellurium from Arsenic. Journalof the Electrochemical Society. 1960, 107 (12): 982–985. doi:10.1149/1.2427585.
- ^ Eric Lichtfouse ... (Hrsg.). Electrodialytical Removal of Cu, Cr and As from Threaded Wood. Lichtfouse, Eric; Schwarzbauer, Jan; Robert, Didier (编). Environmental Chemistry: Green Chemistry and Pollutants in Ecosystems. Berlin: Springer. 2004. ISBN 9783540228608.
- ^ Mandal, Badal Kumar; Suzuki, Kazuo T. Arsenic round the world: a review. Talanta. 2002, 58 (1): 201–235. doi:10.1016/S0039-9140(02)00268-0.
- ^ Reese, Jr., Robert G. Commodity Summaries 2002: Arsenic (PDF). United States Geological Survey. [2008-11-08].
- ^ Rahman, Farhana Alamgir; Allan, Deborah L.; Rosen, Carl J.; Sadowsky, Michael J. Arsenic Availability from Chromated Copper Arsenate (CCA)–Treated Wood. Journal of Enviromental Quality. 2004, 33 (1): 173–180. 已忽略未知参数
|day=(帮助); 已忽略未知参数|month=(建议使用|date=) (帮助); - ^ Antman, Karen H. The History of Arsenic Trioxide in Cancer Therapy. Introduction to a supplement to The Oncologist. 2001, 6 (Suppl 2): 1–2. PMID 11331433. doi:10.1634/theoncologist.6-suppl_2-1.
- ^ Huet; et al. Noncirrhotic presinusoidal portal hypertension associated with chronic arsenical intoxication.. Gastroenterology. 1975, 68' (5 Pt 1): 1270–1277. PMID 1126603.
- ^ Jennewein, Marc; Lewis,Matthew A.; Zhao, Dawen; Tsyganov, Edward; Slavine, Nikolai; He, Jin; Watkins, Linda; Kodibagkar, Vikram D.; O'Kelly, Sean; Kulkarni, Padmakar; Antich, Peter P.M; Hermanne, Alex; Rösch, Frank; Mason Ralph P.; Thorpe, Philip E. Vascular Imaging of Solid Tumors in Rats with a Radioactive Arsenic-Labeled Antibody that Binds Exposed Phosphatidylserine. Journal of Clinical Cancer. 2008, 14: 1377–1385. PMID 18316558. doi:10.1158/1078-0432.CCR-07-1516.
- ^ Timbrell, John. Butter Yellow and Scheele's Green. The Poison Paradox: Chemicals as Friends and Foes. Oxford University Press. 2005. ISBN 9780192804952.
- ^ Code Red - Weapons of Mass Destruction [Online Resource] - Blister Agents
- ^ Peryea F.J. 1998. Historical use of lead arsenate insecticides, resulting in soil contamination and implications for soil remediation. Proceedings, 16th World Congress of Soil Science, Montpellier, France. 20–26. Aug. Available online: http://soils.tfrec.wsu.edu/leadhistory.htm
- ^ Nachman, Keeve E.; Graham, Jay P.; Price, Lance B.; Silbergeld, Ellen K. Arsenic: A Roadblock to Potential Animal Waste Management Solutions. Environmental Health Perspective. 2005, 113 (9): 1123–1124. doi:10.1289/ehp.7834.
- ^ Jones, F. T. A Broad View of Arsenic. Poultry Science. 2007, 86 (1): 2–14. PMID 17179408. 已忽略未知参数
|day=(帮助); 已忽略未知参数|month=(建议使用|date=) (帮助) - ^ Guruswamy, Sivaraman. XIV. Ammunition. Engineering Properties and Applications of Lead Alloys. CRC Press. 1999: 569–570. ISBN 9780824782474.
- ^ Bentley, Ronald; Chasteen, Thomas G. Microbial Methylation of Metalloids: Arsenic, Antimony, and Bismuth. Microbiology and Molecular Biology Reviews. 2002, 66 (2): 250–271. PMID 12040126. doi:10.1128/MMBR.66.2.250-271.2002.
- ^ Cullen, William R.; Reimer, Kenneth J. Arsenic speciation in the environment. Chemical Reviews. 1989;, 89 (4): 713–764. doi:10.1021/cr00094a002.
- ^ Kulp, T. R.; et al. Arsenic(III) fuels anoxygenic photosynthesis in hot spring biofilms from Mono Lake, California.. Science. 2008, 321 (5891): 967–970. PMID 18703741. doi:10.1126/science.1160799. 简明摘要 – Chemistry World, 15 August 2008.
- ^ Klaassen, Curtis; Watkins, John. Casarett and Doull's Essentials of Toxicology. McGraw-Hill. 2003: 512. ISBN 978-0071389143.
- ^ Croal, Laura R., Jeffrey A. Gralnick, Davin Malasarn, and Dianne K. Newman. "The Genetics of Geochemisty." Annual Review of Genetics 38.1 (2004): 175–206. 24 April, 2006. <http://web103.epnet.com>
- ^ AJ Giannini. The Psychiatric, Psychogenic ans Somatopsychic Disorders Handbook New Hyde Park, NY. Medical Examination Publishing Co.1978, pp. 81–82.
- ^ Andrew Meharg, Venomous Earth - How Arsenic Caused The World's Worst Mass Poisoning, Macmillan Science, 2005.
- ^ Lamm SH, Engel A, Penn CA, Chen R, Feinleib M. Arsenic cancer risk confounder in southwest Taiwan data set. Environ. Health Perspect. 2006, 114 (7): 1077–82. PMID 16835062.
- ^ Kohnhorst, Andrew; Allan, Laird; Pokethitiyoke, Prayad; Anyapo, SuthidaThailand. Groundwater arsenic in central Thailand (PDF). 28th WEDC Conference Calcutta. 2002 [2009-01-29].
- ^ Knobeloch LM, Zierold KM, Anderson HA. Association of arsenic-contaminated drinking-water with prevalence of skin cancer in Wisconsin's Fox River Valley. J Health Popul Nutr. 2006, 24 (2): 206–13. PMID 17195561.
- ^ Ferreccio C, Sancha AM. Arsenic exposure and its impact on health in Chile. J Health Popul Nutr. 2006, 24 (2): 164–75. PMID 17195557.
- ^ Chu HA, Crawford-Brown DJ. Inorganic arsenic in drinking water and bladder cancer: a meta-analysis for dose-response assessment. Int J Environ Res Public Health. 2006, 3 (4): 316–22. PMID 17159272. doi:10.3390/ijerph2006030039.
- ^ Arsenic in drinking water seen as threat - USATODAY.com. [2008-01-01].
- ^ www.insituarsenic.org
- ^ Yavuz, Cafer T.; et al. Low-Field Magnetic Separation of Monodisperse Fe3O4 Nanocrystals. Science. 2005, 314 (5801): 964–967. PMID 17095696. doi:10.1126/science.1131475.
- ^ OSHA Arsenic. United States Occupational Safety and Health Administration. [2007-10-08].
外部連接
[编辑]- Los Alamos National Laboratory – Arsenic
- CTD's Arsenic page and CTD's Arsenicals page from the Comparative Toxicogenomics Database
- A Small Dose of Toxicology
- ATSDR - Case Studies in Environmental Medicine: Arsenic Toxicity
- Contaminant Focus: Arsenic by the EPA.
- Environmental Health Criteria for Arsenic and Arsenic Compounds, 2001 by the WHO.
- Evaluation of the carcinogenicity of arsenic and arsenic compounds by the IARC.
- National Institute for Occupational Safety and Health - Arsenic Page
- National Pollutant Inventory - Arsenic
- origen.net – CCA wood and arsenic: toxicological effects of arsenic
- WebElements.com – Arsenic