正黏液病毒科
| 正黏液病毒科 | |
|---|---|
| |
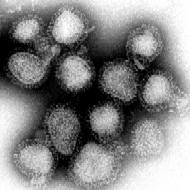
| 電子顯微鏡下的流行性感冒病毒 | |
| 科学分类 | |
| (未分级): | 病毒 Virus |
| 域: | 核糖病毒域 Riboviria |
| 界: | 正核糖病毒界 Orthornavirae |
| 门: | 負核糖病毒門 Negarnaviricota |
| 纲: | 泛流感病毒纲 Insthoviricetes |
| 目: | 分节段病毒目 Articulavirales |
| 科: | 正黏液病毒科 Orthomyxoviridae |
| 属 | |
|
甲型流行性感冒病毒属 | |
| 流行性感冒 |
|---|
 |
| 類型 |
| 疫苗 |
| 治療 |
| 大流行 |
| 爆發疫情 |
| 參見 |
正黏液病毒科(Orthomyxoviridae,希臘文Orthos有「正確,直」之意;myxo有「粘液」之意[1])屬於負鏈RNA病毒,共有六個屬,此科的病毒可感染脊椎動物。造成流行性感冒的病毒正是正黏液病毒科的一員,屬於負鏈RNA病毒。正黏液病毒科可分為五屬病毒,三屬為流行性感冒病毒,分為A型、B型及C型流行性感冒病毒,以及传染性鲑鱼贫血病毒屬和托高土病毒屬。流行性感冒病毒可以感染人、馬、豬及禽類(參見禽流感),其中A型流行性感冒病毒可以感染人、豬、馬及鳥類,而B型流行性感冒,僅可感染人類。C型流行性感冒病毒僅感染人、豬,造成之病害較少。 A型及B型流行性感冒病毒之感染力非常強,傳播速度非常快,可以稱之為最重要的疾病之一,感染範圍遍及世界各大洲。水禽類,尤其是候鳥,為各不同血清型病毒之帶原者及病毒重組之動物。传染性鲑鱼贫血病毒感染鮭魚,托高土病毒則可以感染脊椎動物及非脊椎動物,如蚊子和海蝨[2][3][4]。
本科中有三屬為流感病毒,其分類方法依照其表面NP及M抗原相異性:
分類
[编辑]按系統分類學,此科屬於RNA病毒的ssRNA(-),其關聯物種及血清型如下表所示:
| 屬 | 種(*為模式種) | 血清型或亞型 | 寄主 |
|---|---|---|---|
| A型流感病毒 | A型流感病毒* | H1N1、H1N2、H2N2、H3N1、H3N2、H3N8 、H5N1、H5N2、H5N3、H5N8、H5N9、H7N1 、H7N2、H7N3、H7N4、H7N7、H7N9、H9N2 、H10N7 |
人、豬、鳥,和馬 |
| B型流感病毒 | B型流感病毒* | Victoria, Yamagata[5] | 人、海豹 |
| C型流感病毒 | C型流感病毒* | 人、豬、狗 | |
| 传染性鲑鱼贫血病毒 | 传染性鲑鱼贫血病毒* | 大西洋鮭魚 | |
| 托高土病毒 | 托高土病毒* | 蜱、蚊子、哺乳類(包含人) | |
| 多里病毒 | Batken Virus、Dhori Virus、Jos Virus | ||
| Quarja Viruses [6] | |||
| Quaranfil Virus、Johnston Atoll Virus |
病毒學
[编辑]形態學
[编辑]
流行性感冒病毒係依其基質蛋白(matrix protein)及內部核糖核蛋白(ribonucleoprotein;可溶性抗原)之抗原特性而分為A、B及C三種,外層蛋白包括血球凝集素(hemagglutinin,HA)及神經氨酸酶(neuraminidase, NA)兩種,也為組成流行性感冒的抗原成份。流行性感冒病毒依其血球凝集素及神經胺酸酶之抗原性不同可再分為數種亞型,現今已知血球凝集素已有十六種(H1-H16),神經胺酸酶則有九種。C型流行性感冒之化學性及結構性與 A 及 B 型流行性感冒皆十分相似,但它缺少神經胺酸酶,只有一種血球凝集素酶,在病毒表面上具有一特殊的接受器(receptor),使病毒表面呈蜂窩狀,而 A 型及 B 型流行性感冒很少呈蜂窩狀。
流行性感冒病毒在電子顯微鏡下有絲狀及多形性二種,但大部份為多形性,負染色時常為 70 - 120 nm 之圓形顆粒。新分離的流行性感冒病毒顆粒,其大小及形狀皆不一致,絲狀者經常可長達幾百奈米(nanometer),甚至長達 4,000 nm,有時可以見到一些奇形怪狀者,流行性感冒病毒與其它病毒不同的是它的整個病毒表面有約略等距間隔的突起,一種為長約 10 - 14 nm,寬約 4 nm ,橫切面為三角形,含有血球凝集素的桿狀突起,另一為長約 9 nm,寬約 5 nm,含有神經胺酸酶的圓柱狀突起。
在針狀突起層下面為一包圍基質蛋白及核酸蛋白之脂質被膜, A型流行性感冒病毒之核蛋白衣(nucleocapsid)含有與病毒 RNA 相連的 RNA 聚合酶, B 型及 C 型流行性感冒病毒之核蛋白衣亦可能有相同的結構。病毒封套(envelope)厚度為 6 至 8 nm,當封套破裂或染色液滲入時,可能會看到核酸呈摺疊狀平行的條狀結構。以清潔劑處理也可能會得到大小不等的極度卷曲形狀的核蛋白衣。
C 型流行性感冒病毒外型與 A或B型結構大致相同,不容易區分,有時可見病毒表面有六角型的結構,通常在電子顯微鏡下,同一視野中可能會同時見到這兩種不同形狀的病毒顆粒。
血球凝集素可附著於不同動物的紅血球,而使紅血球凝集,而神經胺酸酶與病毒離開寄主細胞有關,神經胺酸酶會分解膜上的神經胺酸,而使病毒由寄主細胞脫離感染其他細胞。 C 型流行性感冒病毒也含有可破壞流行性感冒接受器的酶,但它與神經胺酸酶不同。
基因體
[编辑]這一科的病毒包含 6 至 8 條的 負義 單股 rna 片段。[7]
總基因體長度為 12000 至 15000 個核苷酸(nt)。最大的片段含 2300 至 2500 個核苷酸 ; 次大的片段含 2300 至 2500 個核苷酸 ; 第三大的片段含 2200 至 2300 個核苷酸 ; 第四大的片段含 1700 至 1800 個核苷酸 ; 第五大的片段含 1500 至 1600 個核苷酸 ; 第六大的片段含 1400 至 1500 個核苷酸 ; 第七大的片段含 1000 至 1100 個核苷酸 ; 第八大的片段含 800 至 900 個核苷酸。基因體片段在兩末端皆有重複序列。5'端以 12 至 13 個核苷酸重複 ; 3'端則以 9 至 11 個核苷酸重複。在本科的各屬病毒中皆然。重複序列多數發生在 RNA 片段上,且在所有 RNA 病毒發生。殼體內的核醣核酸為完整的基因體。每一株病毒可能都包含有缺陷的干擾副本。
結構
[编辑]以下的描述適用於 A型流感病毒, 但其他流感病毒的結構均與其類似:[8]
A型流感病毒直徑約 80 至 120 nm ,通常大致呈現球狀, 但也有絲狀的流感病毒存在。[9]與一般的病毒不同 , A型流感病毒的基因體並非僅由一條核醣核酸組成; 相反地 , 它包含八條單股負義RNA片段 (共 13500 個鹼基對)。這些 RNA 片段編碼共 11 個蛋白質 (HA, NA, NP, M1, M2, NS1, NEP, PA, PB1, PB1-F2, PB2)。[10]這些病毒蛋白中最具代表性的是 血球凝集素 與 神經氨酸酶, 它們兩個是病毒外表面上的糖蛋白。神經氨酸酶是一種能夠將病毒複製體自受感染細胞釋放的酵素,作用機制為催化水解成熟病毒顆粒與宿主細胞間的糖苷鍵。相較之下, 血球凝集素是一種凝集素,負責將病毒結合到目標細胞上,並使病毒基因體能夠進入目標細胞。[11]血球凝集素(H)與神經氨酸酶(N)是抗病毒藥物的作用對象。[12]這兩種蛋白能夠被抗體識別,也就是說,它們被視作抗原。[13]抗體對這兩種蛋白的反應被用來分類不同血清型的A型流感病毒,因此在H5N1的名稱中使用了H與N。

複製週期
[编辑]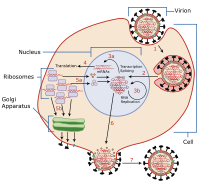
一般而言,流感是由感染病毒的哺乳類在咳嗽或是打噴嚏時,形成帶有病毒的氣膠並以此進行傳播;或者經由受感染鳥類的糞便傳播。流感也能夠透過唾液、鼻分泌物、糞便與血液傳播。感染透過接觸這些體液或受汙染的表面發生。流感病毒在體溫可以保持一周的感染力;在零度時則可以超過三十天;在極低溫的環境下(如東北西伯利亞的湖泊),流感病毒能夠無期限地保持感染力。消毒劑與清潔劑可以輕易地對流感病毒達成減活的效果。[14][15][16]
透過血球凝集素與肺、喉嚨處的上皮細胞表面的唾液酸受體之間形成的鍵結,病毒能夠結合到目標細胞上(感染過程示意圖的階段1)。[17]目標細胞經由內吞作用將病毒帶入。在酸性的胞內體裡,部分的血球凝集素蛋白會連接病毒的封套與囊泡的雙層磷脂質膜,從而將病毒RNA分子(vRNA)、輔助蛋白與RNA依賴性RNA聚合酶釋入細胞質(階段2)。[18]這些蛋白質與病毒RNA分子形成一個複合體,接著被送入細胞核。在細胞核內,RNA依賴性RNA聚合酶開始合成互補的正義cRNA(階段3a、3b)。[19]cRNA或被運輸到到細胞核外(階段4),或停留在核內。新合成的病毒蛋白會由高爾基體分泌到細胞膜上(例如神經氨酸酶和血球凝集素,如階段5b所示),或是運回細胞核內,與病毒RNA結合,形成新的病毒基因體(階段5a)。其他病毒蛋白在宿主細胞內有著複雜的行為,諸如降解細胞的mRNA並利用由此釋出的核苷酸合成病毒RNA,或是抑制宿主細胞mRNA的轉譯作用。[20]
單股負義RNA(用以形成新的病毒基因體)、RNA依賴性RNA聚合酶與其他病毒蛋白共同組合成病毒粒子。血球凝集素與神經氨酸酶分子聚集到細胞膜上,形成突起的結構。病毒RNA與病毒核蛋白緊接著離開細胞核,並進入上述細胞膜上的突起結構(階段6)。成熟的病毒粒子以宿主細胞的磷脂質膜包裹成球狀,帶著膜上的血球凝集素與神經氨酸酶自宿主細胞出芽(階段7)。[21]與起初附著於宿主細胞上的情形相同,病毒封膜上的血球凝集素會與細胞膜形成鍵結。一旦神經氨酸酶將唾液酸殘基與宿主細胞間的鍵結水解,成熟的病毒便會脫離宿主細胞。[17]
正黏液病毒是少數在細胞核中複製RNA的病毒之一。這是因為正黏液病毒科的病毒無法自行合成mRNA。它們通過稱為端帽捕獲(cap-snatching)的程序,將宿主細胞的RNA用作引子,以啟動病毒mRNA的合成。[22]進入細胞核後,RNA聚合酶PB2會結合到mRNA前體的5'端帽上。接著RNA聚合酶PA將mRNA切除,留下5'端帽片段,用作複製病毒mRNA的引子。[23]5'端帽對於mRNA而言是必須的,因為宿主細胞的核糖體可以辨識5'端帽,並開啟mRNA的轉譯。
由於缺少與校正RNA相關的酶,RNA依賴性RNA轉錄酶的錯誤率約為每一萬個核苷酸(約略是流感病毒RNA的長度)發生一次誤寫。所以,幾乎每一個新合成的流感病毒基因體都包含至少一個突變點。.[24]流感病毒的基因體被分散到八段獨立的RNA片段中。因此,當多於一種品系的流感病毒同時感染同一個宿主細胞(重複感染)時,RNA片段可能會重新分配。由此產生的基因片段的替換會使子代病毒表現新的行為。這些可能發生的行為包含感染新的物種,以及對原宿主物種針對病毒舊有抗原的免疫能力產生抗性(一般稱為抗原轉移)。[13]
分類
[编辑]本科下有三個流感病毒屬:A型流感病毒屬、B型流感病毒屬與C型流感病毒屬。每一個屬都只包含一個物種,或者類型。它們分別是:A型流感病毒、B型流感病毒與C型流感病毒。A型與C型流感病毒皆能感染多種物種,而B型流感病毒的宿主幾乎只限於人類。[25][26]
A型流感病毒
[编辑]A型流感病毒可再根據其表面的血球凝集素(HA或H)與神經氨酸酶(NA或N)再細分為多個亞型。實驗已經辨識並確認了十六個血球凝集素與九個神經氨酸酶的血清型。
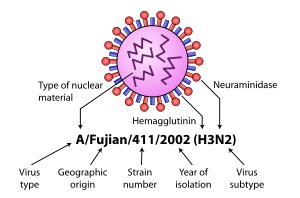
除此之外,在A型流感病毒體間仍存在有許多變異。於是,每一個流感病毒株都被以特定的命名方式確認。命名的原則包含首先將其分離的地點、表示分離順序的編號、分離的年份,以及血球凝集素與神經氨酸酶的血清型。[27][28]
以下為病毒命名的範例:
- A/布里斯本/59/2007 (H1N1)
- A/莫斯科/10/99 (H3N2)
A型流感病毒在三種流感病毒中是對人類最致命的病原體,並且造成大部分的嚴重疾病。下面依照流行病爆發時的死亡人數,排列出已識別的血清型:
- H1N1 在1918年引發"西班牙型流行性感冒",在2009年引發"豬流感"。[29]
- H2N2 在1957年引發"亞洲流感"。
- H3N2 在1968年引發"香港流感"。
- H5N1 可能導致大流行。
- H7N7 擁有少見的人畜共通的可能性。[30]
- H1N2 造成地區性的人、豬流感。
- H9N2、H7N2、H7N3、H10N7。
| 名稱 | 日期 | 死亡人數 | 致死率 | 流感亞型 | 大流行嚴重指數 |
|---|---|---|---|---|---|
| 1889年到1890年流感大流行 (亞洲或俄國流感)[33] |
1889年到1890年 | 1百萬 | 0.15% | 可能為H3N8 或是H2N2 |
N/A |
| 1918年流感大流行 (西班牙流感)[34] |
1918年到1920年 | 2千萬到1億 | 2% | H1N1 | 5 |
| 亞洲流感 | 1957年到1958年 | 1百萬到150萬 | 0.13% | H2N2 | 2 |
| 香港流感 | 1968年到1969年 | 75萬到1百萬 | <0.1% | H3N2 | 2 |
| 俄國流感 | 1977年到1978年 | 無精確統計數字 | N/A | H1N1 | N/A |
| 2009年流感大流行[35][36] | 2009年到2010年 | 18,000 | 0.03% | H1N1 | N/A |
B型流感病毒
[编辑]B型流感病毒的專一性幾乎僅限於人類,且相對於A型流感病毒而言並不普遍。除了人類以外,目前已知能夠感染B型流感病毒的動物只有海豹。[37]本型流感病毒的突變速率僅約A型流感病毒的1/2到1/3,[38]因此其基因多樣性較低,且只有一種血清型。[25]由於B型流感病毒的抗原變異性偏低,人類通常在幼年即可獲得一定程度的免疫。然而,B型流感病毒的持續突變仍舊破壞了終身免疫的可能性。[39]偏低的突變率以及狹隘的寄宿範圍(這使跨物種的抗原轉移無法發生)導致抗原罕有變異,從而確保了B型流感病毒的感染不會演變為大規模的流行事件。[40]
C型流感病毒
[编辑]C型流感病毒能夠感染人類與豬,並造成嚴重的疾病與地區性的流行病。[41]然而,相較其他類型的流感病毒,C型流感病毒並不普遍,且通常只對孩童造成輕度的病症。[42][43]
活性與消毒
[编辑]感染哺乳動物的病毒通常不太穩定,但基本上能夠在黏膜的分泌物中存活數小時。[44]禽流感病毒可以在室溫下的蒸餾水中存活100天,若是在17 °C(63 °F)下則可存活200天。禽流感病毒在糞肥中失去活性的時間較短,但在鳥籠內的糞便中仍可保持約2周的活性。禽流感病毒在冰凍的環境下可以無限期地保持活性。[44]流感病毒可以漂白水、70%的酒精、醛類、氧化劑以及四級銨離子化合物完成消毒。以133 °F(56 °C)加熱60分鐘,或是使用強酸同樣能夠使流感病毒失去活性。[44]
疫苗與預防
[编辑]疫苗及藥物可以分別用來預防及治療流行性感冒。針對A型流感病毒的疫苗含有去活或減活的H1N1與H3N2病毒粒子,對於B型流感病毒而言亦然。由於自然界中病毒的抗原性持續演化,每年都必須更新疫苗的成分,即病毒株的品系。然而,當疫苗給予接種者的免疫能力並未涵蓋自然界中病毒的抗原時,疫苗接種便無法提供適當的保護。即便疫苗提供的免疫能力能夠攻擊病毒的抗原,病毒產生突變,致使疫苗失去保護功能的情形亦時常發生。金剛烷胺與金剛乙胺可以用作治療流行性感冒的藥物,作用機制為干擾M2蛋白,從而抑制病毒粒子由衣殼中釋放。奧司他韋(商品名:克流感)、Zanamivir、Peramivir則能夠透過干擾神經氨酸酶,抑制病毒粒子自受感染細胞中釋放。比起使用奧斯他韋等阻斷神經胺酸脢的藥物,病毒逃脫性突變的發生頻率在使用金剛烷胺與金剛乙胺時較高。[45]
流行病學
[编辑]台灣於1972年時首次發現家禽流行性感冒病毒感染症,血清型為H6N1 ,現今在台灣H血清型共十型 (H1,2,3,4,6,7,8,10,11,14), N血清型共八型 (N1,2,3,4,6,7,8,9) ,其組合共十五種。A型流行性感冒病毒對豬而言,可造成嚴重的增殖性壞死性肺炎。
參考文獻
[编辑]- ^ International Committee on Taxonomy of Viruses (页面存档备份,存于互联网档案馆) Index of Viruses — Orthomyxovirus (2006). In: ICTVdB—The Universal Virus Database, version 4. Büchen-Osmond, C (Ed), Columbia University, New York, USA.
- ^ Jones LD, Nuttall PA. Non-viraemic transmission of Thogoto virus: influence of time and distance. Trans. R. Soc. Trop. Med. Hyg. 1989, 83 (5): 712–4. PMID 2617637. doi:10.1016/0035-9203(89)90405-7.
- ^ Barry Ely. Infectious Salmon Anaemia. Mill Hill Essays. National Institute for Medical Research. 1999 [2007-09-14]. (原始内容存档于2007-08-24).
- ^ Raynard RS, Murray AG, Gregory A. Infectious salmon anaemia virus in wild fish from Scotland. Dis. Aquat. Org. 2001, 46 (2): 93–100. PMID 11678233. doi:10.3354/dao046093.
- ^ Differentiation of Influenza B Virus Lineages Yamagata and Victoria by Real-Time PCR, in: Journal of Clinical Microbiology, Jan. 2013, Vol. 51, Issue 1, by B. Biere, B. Bauer, B. Schweiger. [2015-01-11]. (原始内容存档于2013-02-15).
- ^ ICTV Taxonomy History, ICTV, 2014 [6 June 2006], (原始内容存档于2015-04-02)
- ^ 存档副本. [2015-01-11]. (原始内容存档于2011-03-11).
- ^ International Committee on Taxonomy of Viruses descriptions of: Orthomyxoviridae (页面存档备份,存于互联网档案馆) Influenzavirus B (页面存档备份,存于互联网档案馆) Influenzavirus C (页面存档备份,存于互联网档案馆)
- ^ International Committee on Taxonomy of Viruses. The Universal Virus Database, version 4: Influenza A. [2015-01-11]. (原始内容存档于2010-01-13).
- ^ Ghedin E, Sengamalay N, Shumway M, Zaborsky J, Feldblyum T, Subbu V, Spiro D, Sitz J, Koo H, Bolotov P, Dernovoy D, Tatusova T, Bao Y, St George K, Taylor J, Lipman D, Fraser C, Taubenberger J, Salzberg S. Large-scale sequencing of human influenza reveals the dynamic nature of viral genome evolution. Nature. Oct 20, 2005, 437 (7062): 1162–6. Bibcode:2005Natur.437.1162G. PMID 16208317. doi:10.1038/nature04239.
- ^ Suzuki Y. Sialobiology of influenza: molecular mechanism of host range variation of influenza viruses. Biol Pharm Bull. 2005, 28 (3): 399–408 [2015-01-11]. PMID 15744059. doi:10.1248/bpb.28.399. (原始内容存档于2009-01-12).
- ^ Wilson J, von Itzstein M. Recent strategies in the search for new anti-influenza therapies. Curr Drug Targets. July 2003, 4 (5): 389–408. PMID 12816348. doi:10.2174/1389450033491019.
- ^ 13.0 13.1 13.2 Hilleman, M. Realities and enigmas of human viral influenza: pathogenesis, epidemiology and control. Vaccine. 19 August 2002, 20 (25–26): 3068–87. PMID 12163258. doi:10.1016/S0264-410X(02)00254-2.
- ^ Suarez, D; Spackman E; Senne D; Bulaga L; Welsch A; Froberg K. The effect of various disinfectants on detection of avian influenza virus by real time RT-PCR. Avian Dis. 2003, 47 (3 Suppl): 1091–5. PMID 14575118. doi:10.1637/0005-2086-47.s3.1091.
- ^ Avian Influenza (Bird Flu) (页面存档备份,存于互联网档案馆): Implications for Human Disease. Physical characteristics of influenza A viruses. UMN CIDRAP.
- ^ Flu viruses 'can live for decades' on ice. The New Zealand Herald. Reuters. November 30, 2006 [November 1, 2011]. (原始内容存档于2020-07-01).
- ^ 17.0 17.1 Wagner R, Matrosovich M, Klenk H. Functional balance between haemagglutinin and neuraminidase in influenza virus infections. Rev Med Virol. May–Jun 2002, 12 (3): 159–66. PMID 11987141. doi:10.1002/rmv.352.
- ^ Lakadamyali M, Rust M, Babcock H, Zhuang X. Visualizing infection of individual influenza viruses. Proc Natl Acad Sci USA. Aug 5, 2003, 100 (16): 9280–5. Bibcode:2003PNAS..100.9280L. PMC 170909
 . PMID 12883000. doi:10.1073/pnas.0832269100.
. PMID 12883000. doi:10.1073/pnas.0832269100.
- ^ Cros J, Palese P. Trafficking of viral genomic RNA into and out of the nucleus: influenza, Thogoto and Borna disease viruses. Virus Res. September 2003, 95 (1–2): 3–12. PMID 12921991. doi:10.1016/S0168-1702(03)00159-X.
- ^ Kash J, Goodman A, Korth M, Katze M. Hijacking of the host-cell response and translational control during influenza virus infection. Virus Res. July 2006, 119 (1): 111–20. PMID 16630668. doi:10.1016/j.virusres.2005.10.013.
- ^ Nayak D, Hui E, Barman S. Assembly and budding of influenza virus. Virus Res. December 2004, 106 (2): 147–65. PMID 15567494. doi:10.1016/j.virusres.2004.08.012.
- ^ Cap Snatching. ViralZone. expasy. [11 September 2014]. (原始内容存档于2014-12-24).
- ^ Dias, Alexandre; Bouvier, Denis; Crépin, Thibaut; McCarthy, Andrew A.; Hart, Darren J.; Baudin, Florence; Cusack, Stephen; Ruigrok, Rob W. H. The cap-snatching endonuclease of influenza virus polymerase resides in the PA subunit. Nature. 4 February 2009, 458 (7240): 914–918. doi:10.1038/nature07745.
- ^ Drake J. Rates of spontaneous mutation among RNA viruses. Proc Natl Acad Sci USA. May 1, 1993, 90 (9): 4171–5. Bibcode:1993PNAS...90.4171D. PMC 46468
 . PMID 8387212. doi:10.1073/pnas.90.9.4171.
. PMID 8387212. doi:10.1073/pnas.90.9.4171.
- ^ 25.0 25.1 Hay A, Gregory V, Douglas A, Lin Y. The evolution of human influenza viruses (PDF). Philos Trans R Soc Lond B Biol Sci. Dec 29, 2001, 356 (1416): 1861–70. PMC 1088562
 . PMID 11779385. doi:10.1098/rstb.2001.0999.[永久失效連結]
. PMID 11779385. doi:10.1098/rstb.2001.0999.[永久失效連結]
- ^ Avian Influenza (Bird Flu). Centers for Disease Control and Prevention. [2007-09-15]. (原始内容存档于2005-11-26).
- ^ Atkinson W, Hamborsky J, McIntyre L, Wolfe S (编). Epidemiology and Prevention of Vaccine-Preventable Diseases 10th. Washington DC: Centers for Disease Control and Prevention. 2007 [2015-01-11]. (原始内容存档于2007-06-20).
- ^ Avian Influenza (Bird Flu): Implications for Human Disease. Center for Infectious Disease Research & Policy, University of Minnesota. 2007-06-27 [2007-09-14]. (原始内容存档于2013-06-17).
- ^ Wang TT, Palese P. Unraveling the Mystery of Swine Influenza Virus. Cell. June 2009, 137 (6): 983–5. PMID 19524497. doi:10.1016/j.cell.2009.05.032.
- ^ Fouchier R, Schneeberger P, Rozendaal F, Broekman J, Kemink S, Munster V, Kuiken T, Rimmelzwaan G, Schutten M, Van Doornum G, Koch G, Bosman A, Koopmans M, Osterhaus A. Avian influenza A virus (H7N7) associated with human conjunctivitis and a fatal case of acute respiratory distress syndrome. Proc Natl Acad Sci USA. 2004, 101 (5): 1356–61. Bibcode:2004PNAS..101.1356F. PMC 337057
 . PMID 14745020. doi:10.1073/pnas.0308352100.
. PMID 14745020. doi:10.1073/pnas.0308352100.
- ^ Potter CW. A History of Influenza. Journal of Applied Microbiology. October 2001, 91 (4): 572–579 [2015-01-11]. PMID 11576290. doi:10.1046/j.1365-2672.2001.01492.x. (原始内容存档于2018-01-21).
- ^ Ten things you need to know about pandemic influenza. World Health Organization. 14 October 2005 [26 September 2009]. (原始内容存档于2009年9月23日).
- ^ Valleron AJ, Cori A, Valtat S, Meurisse S, Carrat F, Boëlle PY. Transmissibility and geographic spread of the 1889 influenza pandemic. Proc. Natl. Acad. Sci. USA. May 2010, 107 (19): 8778–81. Bibcode:2010PNAS..107.8778V. PMC 2889325
 . PMID 20421481. doi:10.1073/pnas.1000886107
. PMID 20421481. doi:10.1073/pnas.1000886107  .
.
- ^ Mills CE, Robins JM, Lipsitch M. Transmissibility of 1918 pandemic influenza. Nature. December 2004, 432 (7019): 904–6. Bibcode:2004Natur.432..904M. PMID 15602562. doi:10.1038/nature03063.
- ^ Donaldson LJ, Rutter PD, Ellis BM, et al. Mortality from pandemic A/H1N1 2009 influenza in England: public health surveillance study. BMJ. 2009, 339: b5213. PMC 2791802
 . PMID 20007665. doi:10.1136/bmj.b5213.
. PMID 20007665. doi:10.1136/bmj.b5213.
- ^ ECDC Daily Update – Pandemic (H1N1) 2009 – January 18, 2010 (PDF). European Centre for Disease Prevention and Control. 2010-01-18 [2010-01-18]. (原始内容 (PDF)存档于2010年1月22日).
- ^ Osterhaus A, Rimmelzwaan G, Martina B, Bestebroer T, Fouchier R. Influenza B virus in seals. Science. 2000, 288 (5468): 1051–3. Bibcode:2000Sci...288.1051O. PMID 10807575. doi:10.1126/science.288.5468.1051.
- ^ Nobusawa E, Sato K. Comparison of the mutation rates of human influenza A and B viruses. J Virol. April 2006, 80 (7): 3675–8. PMC 1440390
 . PMID 16537638. doi:10.1128/JVI.80.7.3675-3678.2006.
. PMID 16537638. doi:10.1128/JVI.80.7.3675-3678.2006.
- ^ Webster RG, Bean WJ, Gorman OT, Chambers TM, Kawaoka Y. Evolution and ecology of influenza A viruses. Microbiol. Rev. March 1992, 56 (1): 152–79. PMC 372859
 . PMID 1579108.
. PMID 1579108.
- ^ Zambon M. Epidemiology and pathogenesis of influenza. J Antimicrob Chemother. November 1999, 44 (Suppl B): 3–9 [2015-01-11]. PMID 10877456. doi:10.1093/jac/44.suppl_2.3. (原始内容存档于2009-07-01).
- ^ Matsuzaki Y, Sugawara K, Mizuta K, Tsuchiya E, Muraki Y, Hongo S, Suzuki H, Nakamura K. Antigenic and genetic characterization of influenza C viruses which caused two outbreaks in Yamagata City, Japan, in 1996 and 1998. J Clin Microbiol. 2002, 40 (2): 422–9. PMC 153379
 . PMID 11825952. doi:10.1128/JCM.40.2.422-429.2002.
. PMID 11825952. doi:10.1128/JCM.40.2.422-429.2002.
- ^ Matsuzaki Y, Katsushima N, Nagai Y, Shoji M, Itagaki T, Sakamoto M, Kitaoka S, Mizuta K, Nishimura H. Clinical features of influenza C virus infection in children. J Infect Dis. May 1, 2006, 193 (9): 1229–35. PMID 16586359. doi:10.1086/502973.
- ^ Katagiri S, Ohizumi A, Homma M. An outbreak of type C influenza in a children's home. J Infect Dis. July 1983, 148 (1): 51–6. PMID 6309999. doi:10.1093/infdis/148.1.51.
- ^ 44.0 44.1 44.2 http://www.cfsph.iastate.edu/Factsheets/pdfs/influenza.pdf (页面存档备份,存于互联网档案馆), p. 7
- ^ Yoshiyuki Suzuki. Natural selection on the influenza virus genome. Molecular Biology and Evolution. July 3, 2006, 23 (10): 1902–1911 [2015-01-11]. PMID 16818477. doi:10.1093/molbev/msl050. (原始内容存档于2012-03-16).
- Hoyle, L. The Influenza Viruses. Virology Monographs (Springer-Verlag). 1969, 4 [2015-01-11]. ISBN 3-211-80892-2. ISSN 0083-6591. OCLC 4053391. (原始内容存档于2015-04-13).
外部連結
[编辑]- 微生物免疫學-Orthomyxoviridae(正黏液病毒科) (页面存档备份,存于互联网档案馆)
- Health-EU Portal (页面存档备份,存于互联网档案馆) EU work to prepare a global response to influenza.
- Influenza Research Database Database of influenza genomic sequences and related information.
- European Commission—Public Health (页面存档备份,存于互联网档案馆) EU coordination on Pandemic (H1N1) 2009
- 3D Influenza-virus-related structures from the EM Data Bank(EMDB) (页面存档备份,存于互联网档案馆)
